推荐产品
公司新闻/正文
lncRNA研究进展盘点丨20231107期
人阅读 发布时间:2023-11-21 13:27
01
lncRNA Sweetheart调节雄性小鼠心肌损伤后的代偿性心肌肥厚
发表期刊:Nat Commun
影响因子:16.6
发表时间:2023年11月2日
成人心脏心肌梗死后,剩余的非梗死组织适应以补偿功能组织的损失。这种适应需要基因表达网络的变化,而基因表达网络主要由转录调节蛋白控制。长链非编码转录本(lncRNAs)参与了此类基因程序的微调。本研究描述并表征了心肌细胞特异性 lncRNA Sweetheart RNA(Swhtr),这是一个约10 kb长的转录本,从心脏核心转录因子编码基因Nkx2-5发散表达。研究发现Swhtr对于正常的心脏发育和功能是可有可无的,但对于雄性小鼠心肌梗死后的组织适应过程至关重要。从外源位点重新表达Swhtr可挽救Swhtr null表型。心脏应激后依赖于Swhtr的基因被显著占用,因此很可能受到NKX2-5的调节。Swhtr转录本与NKX2-5相互作用并在心肌细胞缺氧应激下分散,表明Swhtr在心肌损伤后的组织适应中对NKX2-5功能起辅助作用。
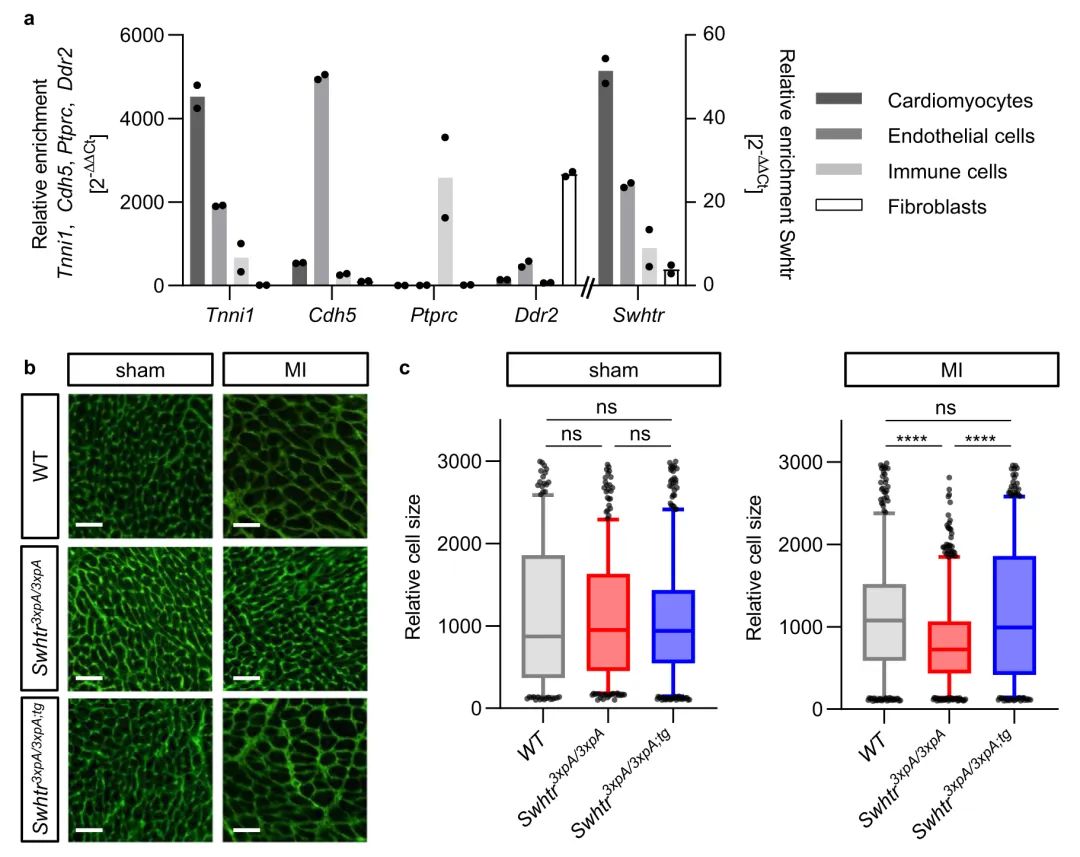
Fig1. Swhtr突变型心肌细胞肥大
原文链接:
https://www.nature.com/articles/s41467-023-42760-y
02
PPARγ/长链非编码RNA轴调节小鼠的脂肪热中性重塑
发表期刊:J Clin Invest
影响因子:15.9
发表时间:2023年11月1日
储存能量的白色脂肪细胞和产热的米色脂肪细胞之间的相互作用有助于肥胖和胰岛素抵抗。无论特殊的生态位如何,脂肪细胞都需要核受体PPARγ的活性才能发挥正常功能。暴露于寒冷或adrenaline能信号通过与PPARγ协同作用的多种途径富集产热细胞;然而,PPARγ允许白色脂肪组织优先采用产热或白色脂肪命运以响应饮食提示或热中性条件的分子机制尚未完全阐明。本研究发现PPARγ/长链非编码RNA(lncRNA)轴整合了典型和非典型产热作用,以抑制热中性和饮食诱导的肥胖期间白色脂肪组织的散热。lncRNA Lexis的药理学抑制或基因缺失增强了解偶联蛋白1(UCP1)依赖性和非依赖性产热作用。脂肪特异性的Lexis缺失抵消了饮食引起的肥胖,提高了胰岛素敏感性,并增加了能量消耗。单核转录组学显示,Lexis调节一种独特的产热脂肪细胞群。研究人员系统地绘制了Lexis基序偏好图,并表明它通过代谢GWAS基因和WNT调节剂TCF7L2的活性来调节产热程序。总的来说,本研究揭示了PPARγ和WNT之间的一种新的串扰模式,该模式保留了白色脂肪组织的可塑性。

Fig2. 研究模型示意图
原文链接:
https://pubmed.ncbi.nlm.nih.gov/37909330/
03
肿瘤相关巨噬细胞源性外泌体LINC01592通过降低MHC-I表面表达诱导食管癌的免疫逃逸发表期刊:J Exp Clin Canc Res
影响因子:11.3
发表时间:2023年11月2日
背景:TAMs(肿瘤相关巨噬细胞)浸润促进食管癌(EC)的进展。然而,其潜在机制仍不清楚。
结果:LINC01592由M2-TAMs分泌的外泌体携带并转移到肿瘤细胞中。促进NBR1转录的分子机制涉及LINC01592与E2F6的直接结合,从而促进了E2F6的核进入。LINC01592和E2F6的协同作用导致NBR1转录的改善。NBR1通过泛素结构域与泛素化蛋白MHC-I结合的升高导致自噬溶酶体中MHC-I的降解更高和癌细胞外部MHC-I表达降低。因此,这导致癌细胞从CD8+ CTL免疫攻击中逃脱。通过siRNA的作用或相应的抗体阻断来中断E2F6/NBR1/MHC-I信号传导,可显著抑制LINC01592的肿瘤促进作用,以及M2型巨噬细胞驱动肿瘤的生长。值得注意的是,抑制LINC01592导致肿瘤细胞膜上MHC-I表达上调,从而增强了CD8 + T细胞回输治疗的疗效。
结论:研究显示,TAMs和EC之间通过LINC01592/E2F6/NBR1/MHC-I轴存在显著的分子相互作用,从而促进恶性肿瘤的进展。这表明,针对该轴的治疗干预可能为该疾病的治疗带来希望。

Fig3. 作用机制示意图
原文链接:
https://jeccr.biomedcentral.com/articles/10.1186/s13046-023-02871-2
04
通过多组分纳米复合物协调调节长链非编码RNA ASBEL和姜黄素共递送用于同步三阴性乳腺癌诊疗
发表期刊:J Nanobiotechnology
影响因子:10.2
发表时间:2023年10月31日
背景:异常调控的长链非编码RNAs(lncRNAs)在癌症中的功能强调了它们作为癌症治疗干预潜在靶点的潜力。LncRNA ASBEL已被鉴定为癌基因和三阴性乳腺癌(TNBC)中 BTG3 肿瘤抑制基因的反义转录本。
结果:本研究设计并制备了基于生物活性透明质酸(HA)和壳聚糖盐酸盐(CS)聚电解质的多组分自组装聚电解质纳米复合物(CANPs),用于共递送antago3(一种靶向lncRNA ASBEL的寡核苷酸拮抗剂)和疏水性姜黄素(Cur)以协同调节致癌lncRNA ASBEL,从而协同治疗TNBC。Antago3和Cur共结合的CAMPs是通过结合非共价静电相互作用、氢键和疏水相互作用的一步组装策略实现的。此外,多组分组装的CAMPs还用近红外荧光(NIRF)Cy-5.5染料(FCANPs)进行装饰,以实现同步NIRF成像和治疗监测性能。结果表明,具有协同模式的FCANPs能有效抑制MDA-MB-231细胞的增殖、迁移和侵袭,并诱导最高的细胞凋亡率。在分子水平上,可以观察到lncRNA ASBEL/BTG3的有效调控以及Bcl-2和c-Met通路的同步调控。
结论:正如预期的那样,全身给药FCANPs导致近红外荧光信号和Cur在肿瘤组织中的靶向和优先积累。更具吸引力的是,全身性FCANPs介导的协同调节lncRNA ASBEL/BTG3和Cur共递送显著抑制了MDA-MB-231异种移植肿瘤的生长,抑制了转移并延长了生存率,而全身毒性可以忽略不计。目前的研究代表了一种有效的方法,可以开发一个有前途的治疗诊断平台,以联合治疗模式对抗TNBC。

Fig4. 含antago3和Cur及其表面近红外荧光修饰的FCANPs的设计及其协同抗癌作用
原文链接:
https://pubmed.ncbi.nlm.nih.gov/37904215/
05
FTO介导的LINC01134稳定通过miR-140-3p/WNT5A/WNT通路促进PDAC化疗耐药性
发表期刊:Cell Death Dis
影响因子:9.0
发表时间:2023年11月1日
胰腺导管腺癌(PDAC)是一种高度侵袭性的癌症,最常在晚期被发现,这限制了全身化疗的治疗选择,而全身化疗仅提供边缘发积极临床结果。目前,PDAC的一线化疗药物是吉西他滨(GEM)。然而,由于缺乏有效的生物标志物,GEM的化疗耐药性在PDAC的临床治疗中往往被忽视。因此,为PDAC患者寻找新的预后标志物和治疗靶点至关重要。本研究确定了PDAC中对GEM耐药性发展的一种新的调控机制。研究发现,LINC01134在PDAC患者的原发性肿瘤中显著上调。体外和体内功能研究表明,LINC01134通过促进干细胞特征和调节细胞周期来促进PDAC对GEM的抗性。机制上,LINC01134与PDAC细胞中肿瘤抑制因子miR-497-5p相互作用。增加的LINC01134可下调miR-140-3p以促进致癌基因WNT5A的表达。此外,m6A去甲基化酶FTO通过YTHDF2维持LINC01134 mRNA稳定性,参与LINC01134的上调。综上所述,本研究表明,FTO介导的LINC01134稳定通过PDAC中的miR-140-3p/WNT5A/WNT通路促进GEM化疗耐药。本研究为PDAC患者确定了新的预后标志物和新的治疗靶点。

Fig5. 研究模型示意图
原文链接:
https://www.nature.com/articles/s41419-023-06244-7