推荐产品
公司新闻/正文
lncRNA研究进展盘点丨20230310期
人阅读 发布时间:2023-04-10 09:33
01
LncRNA-BC069792通过靶向乳腺癌中的KCNQ4来抑制肿瘤进展
发表期刊:Mol Cancer
影响因子:41.444
发表时间:2023年3月1日
背景:乳腺癌是威胁女性健康最常见的恶性肿瘤。长链非编码RNA(lncRNA)在乳腺癌中的研究已引起广泛关注。但具体机制尚不清楚。
结果:研究发现lncRNA BC069792在乳腺癌组织中表达水平较低,在病理分级高、淋巴结转移、Ki-67指数高的乳腺癌中的表达水平显著降低。此外,BC069792在体外和体内均能抑制乳腺癌细胞的增殖、侵袭和转移。在机械上,BC069792作为分子海绵吸附has-miR-658和has-miR-4739,上调钾离子电压门控通道Q4(KCNQ4)的蛋白表达,抑制JAK2和p-AKT的活性,并起到抑制乳腺癌生长的作用。
结论:LncRNA BC069792在乳腺癌中起肿瘤抑制基因的作用,是乳腺癌新的诊断指标和治疗靶点。
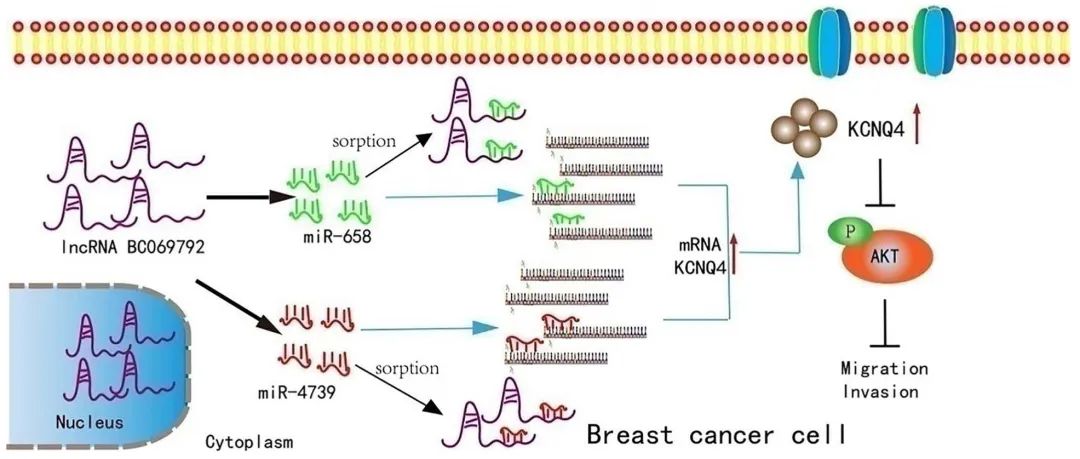
Fig1. lncRNA BC069792抑制乳腺癌肿瘤进展的机制
原文链接:https://pubmed.ncbi.nlm.nih.gov/36859185/
02
LncRNA HOTAIRM1通过其与DNA修复和mRNA监测因子的关联在DNA双链断裂修复中起作用
发表期刊:Nucleic Acids Res
影响因子:19.160
发表时间:2023年3月7日
真核外显子连接复合物组分Y14通过其与非同源末端连接(NHEJ)复合物的RNA依赖性相互作用参与双链断裂(DSB)修复。使用免疫沉淀RNA-seq,本研究鉴定了一组与Y14相关的长链非编码RNAs(lncRNAs)。lncRNA HOTAIRM1是介导Y14和NHEJ复合物之间相互作用的强有力候选基因。HOTAIRM1定位于近紫外激光诱导的DNA损伤位点。HOTAIRM1的缺失延迟了DNA损伤反应和修复因子对DNA损伤的募集,并损害了NHEJ介导的DSB修复的效率。HOTAIRM1相互作用组的鉴定揭示了大量的RNA加工因子,包括mRNA监测因子。监测因子Upf1和SMG6以HOTAIRM1依赖性方式定位于DNA损伤位点。Upf1或SMG6的缺失增加了受损位点DSB诱导的非编码转录本的水平,表明Upf1/SMG6介导的RNA降解在DNA修复中起着关键作用。我们得出结论,HOTAIRM1可作为DNA修复和mRNA监测因子的组装支架,这些因子协同作用以修复DSBs。

Fig2. HOTAIRM1通过其与DNA修复和NMD因子的关联参与DSB修复
原文链接:https://pubmed.ncbi.nlm.nih.gov/36881772/
03
lncRNA AFAP1-AS1的致瘤作用是由翻译肽ATMLP在m6A甲基化控制下介导的
发表期刊:Adv Sci (Weinh)
影响因子:17.521
发表时间:2023年3月4日
长期以来,真核转录本中的长链非编码RNAs(lncRNAs)一直被认为可以调节细胞过程的各个方面,包括致癌作用。本研究发现,lncRNA AFAP1-AS1编码一种位于线粒体上的90个氨基酸的保守肽,命名为lncRNA AFAP1-AS1翻译的线粒体定位肽(ATMLP),促进非小细胞肺癌(NSCLC)恶性进展的不是lncRNA而是肽。随着肿瘤的进展,ATMLP的血清水平增加。ATMLP 水平高的 NSCLC 患者预后较差。ATMLP的翻译由AFAP1-AS1的1313腺嘌呤位点上的m6A甲基化控制。机制上,ATMLP与NIPSNAP1结合,并抑制其从线粒体内膜到线粒体外膜的转运,从而拮抗NIPSNAP1介导的细胞自溶酶体形成的调节。这些发现揭示了lncRNA编码的多肽调节NSCLC恶性肿瘤的复杂调控机制。综合判断了ATMLP作为NSCLC早期诊断生物标志物的应用前景。

Fig3. ATMLP功能模型示意图
原文链接:https://pubmed.ncbi.nlm.nih.gov/36871154/
04
通过OBSCN-AS1 lncRNA CRISPR靶向修复OBSCN抑制三阴性乳腺癌的转移
发表期刊:PNAS
影响因子:12.779
发表时间:2023年3月9日
越来越多的证据表明,由OBSCN基因编码的巨型细胞骨架蛋白obscurin(720~870 kDa)与乳腺癌的易感性和发展有关。因此,先前的研究表明,在致癌KRAS存在的情况下,仅从正常乳腺上皮细胞中缺失OBSCN可增加生存率和化学抵抗力,诱导细胞骨架改变,增强细胞迁移和侵袭,并促进转移。与这些观察结果一致,对Kaplan-Meier Plotter数据集的分析表明,低OBSCN水平与乳腺癌患者的总生存率和无复发生存率显著降低相关。尽管有令人信服的证据表明OBSCN在乳腺肿瘤的发生和进展中缺失,但其调节仍然不清楚,这限制了恢复其表达的任何努力,鉴于其分子复杂性和巨大的分子大小(~170 kb),这将是一个重大挑战。本研究发现源自OBSCN负链的新型核长链非编码RNA(lncRNA)基因OBSCN- Antisense RNA 1(OBSCN-AS1)和OBSCN在乳腺癌活检中表现出正相关表达并下调。OBSCN-AS1通过染色质重塑调节OBSCN表达,该重塑涉及与开放染色质构象相关的H3赖氨酸4三甲基化富集和RNA聚合酶II募集。CRISPR激活三阴性乳腺癌细胞中的OBSCN-AS1可有效特异性地恢复OBSCN的表达,并显著抑制体外三维球状体的细胞迁移、侵袭和扩散以及体内转移。总的来说,这些结果揭示了以前未知的反义lncRNA对OBSCN的调控和OBSCN-AS1/OBSCN基因对的转移抑制功能,这可能被用作转移性乳腺癌的预后生物标志物和/或治疗靶点。

Fig4. OBSCN-AS1在OBSCN转录激活中的调节作用模型
原文链接:https://pubmed.ncbi.nlm.nih.gov/36877839/
05
人类皮肤特异性长链非编码RNA HOXC13-AS通过干扰高尔基-ER逆向运输来调节表皮分化
发表期刊:Cell Death Differ
影响因子:12.067
发表时间:2023年3月3日
皮肤损伤后,角质形成细胞从稳态状态转变为再生状态,导致表皮屏障的重建。在人体皮肤伤口愈合过程中支撑这一关键开关的基因表达的调节机制任然是未知的。长链非编码RNAs(lncRNAs)构成了理解哺乳动物基因组中编码的调控程序的新视野。通过比较来自同一供体的急性人体伤口和皮肤的转录组,以及从这些配对组织样本中分离的角质形成细胞的转录组,研究人员生成了一份lncRNAs列表,显示伤口修复过程中角质形成细胞中的表达发生的变化。本研究集中在HOXC13-AS,一种最近进化的人类lncRNA,其在表皮角质形成细胞中特异性表达,研究发现它的表达在伤口愈合过程中暂时下调。根据其在基底上角质形成细胞中的富集,发现HOXC13-AS在角质形成细胞分化过程中表达增加,但其表达因EGFR信号而降低。在细胞悬液或钙处理诱导分化的人原代角质形成细胞和器官型表皮中敲低或过表达HOXC13-AS后,发现HOXC13-AS促进了角质形成细胞的分化。此外,RNA pull-down测定、质谱和RNA免疫沉淀分析显示HOXC13-AS在机制上螯合了外壳复合物亚基α(COPA)蛋白并干扰了高尔基到内质网(ER)的分子转运,导致ER应激和增强角质形成细胞分化。总之,本研究将HOXC13-AS确定为人类表皮分化的关键调节因子。

Fig5. HOXC13-AS/COPA介导的角质形成细胞分化调控的模型示意图
原文链接:https://pubmed.ncbi.nlm.nih.gov/36869179/