广州市锐博生物科技有限公司品牌商
17 年
手机商铺
- NaN
- 0.7999999999999998
- 1.7999999999999998
- 0.7999999999999998
- 3.8
推荐产品
公司新闻/正文
Nature子刊丨TGF-β1触发的适应不良骨髓内皮阻碍造血恢复
121 人阅读发布时间:2025-10-22 13:30
使用到的RiboBio产品或服务
For gene silencing, small interfering RNA (siRNA) against TGF-βRI was synthesized (RiboBio) was transfected into BMECs cultivated from HDs for 7 days.
核心发现:
本研究揭示了一个由TGF-β1触发的、骨髓血管内皮细胞功能失调驱动的、导致造血恢复不良的全新机制,并成功将这一基础研究发现转化为一种行之有效的治疗策略,为临床难题提供了全新的解决方案。
骨髓(BM)血管微环境是维持终生造血和维持整体血液系统稳态的基础。造血干细胞(HSC)栖息在专门的微环境中,由多种基质成分支持,其中内皮细胞(EC)尤为重要。BM、ECs不仅充当结构支架,还充当分泌血管分泌信号的活性调节因子,影响造血干细胞的静息、增殖和分化。尽管功能重要,骨髓内皮细胞却易受病理损伤。它们在血液疾病中常被破坏,也会因化疗和放疗等临床干预而严重受损。虽然短暂的内皮细胞损伤通常可通过生理性再生修复,但由持续炎症、氧化应激或恶性重塑引起的应激信号的慢性激活,往往会诱导内皮细胞走向适应不良性修复。这种适应不良状态以成纤维细胞样特征和组织特异性功能丧失为特点。具体表现为骨髓血管微环境丧失了维持HSC再生的能力,导致造血衰竭,并出现如移植后造血功能不良(PGF)等临床症状,这是同种异体造血干细胞移植(allo-HSCT)后的一个重要并发症。尽管其临床相关性已很明确,但决定骨髓内皮细胞修复是成功还是适应不良的分子驱动因素仍未完全明了。
在生理条件下,内皮细胞的再生高度依赖于血管内皮生长因子(VEGF)介导的通路。而转化生长因子-β1(TGF-β1)作为一种多效性细胞因子,是内皮细胞可塑性和修复过程的关键调节者,对血管生成和组织重塑产生情境依赖性效应。短暂的TGF-β1激活通过SMAD2/3介导的静息信号促进血管稳定,从而支持稳态。相反,TGF-β1信号的慢性或过度激活则会通过替代性的SMAD1/5信号或非经典通路(如丝裂原活化蛋白激酶MAPK通路)促进纤维化和炎症。既往研究表明,TGF-β1在骨髓微环境中高表达,其在内皮细胞中的表达水平仅次于巨核细胞。这种独特的空间表达模式提示TGF-β1在骨髓内皮细胞生物学中具有特殊作用。
TGF-β1信号的异常上调会破坏骨髓内皮细胞的稳态并损害其造血支持功能。然而,TGF-β1在启动骨髓内皮细胞适应不良修复中的因果作用及其下游分子级联反应仍未明确。重要的是,靶向TGF-β信号通路的药物干预已进入临床。Luspatercept(一种TGF-β配体陷阱)已被证明能改善MDS和地中海贫血患者的红细胞生成,其作用机制涉及增强晚期红细胞成熟。新兴的临床试验数据表明,Luspatercept可能还能改善白细胞和血小板计数,这提出了调节TGF-β信号可能有益于多系造血的可能性。然而,这些治疗效果是否通过恢复骨髓内皮细胞功能介导,仍有待探索。
北京大学血液研究所、国家血液系统疾病临床医学研究中心联合中国科学院遗传与发育研究所的研究人员在《Signal Transduction and Targeted Therapy》期刊发表了一篇名为TGF-β1-triggered maladaptive bone marrow endothelium impedes hematopoietic recovery的研究。研究发现:TGF-β1信号异常激活,导致骨髓内皮细胞适应不良,丧失对造血干细胞的支撑功能。该研究不仅阐明了TGF-β1通路在骨髓微环境适应不良修复中的核心作用,深化了对造血重建不良患者的多谱系造血修复,还开创了以“骨髓微环境修复”为靶点的治疗新模式。

研究结果
TGF-β1 激活会损害骨髓内皮细胞及其造血支持能力
研究人员首先在体外用不同浓度TGF-β1处理健康供者来源的骨髓血管内皮细胞,发现细胞的迁移和形成管状结构的能力受TGF-β1浓度依赖性的抑制。为了确定其因果关系,选择siRNA敲低TGF-β1的受体TGF-βRI,结果显示这不仅能有效减轻由TGF-β1引发的细胞凋亡和氧化应激水平,更恢复了被抑制的细胞迁移与成管能力。最关键的是,抑制该通路成功挽救了骨髓内皮细胞受损的造血支持功能。这些结果共同证明,TGF-β信号通路的过度激活是导致骨髓内皮细胞功能失调的直接原因,而靶向抑制该通路则展现出逆转损伤、促进造血再生的治疗潜力。
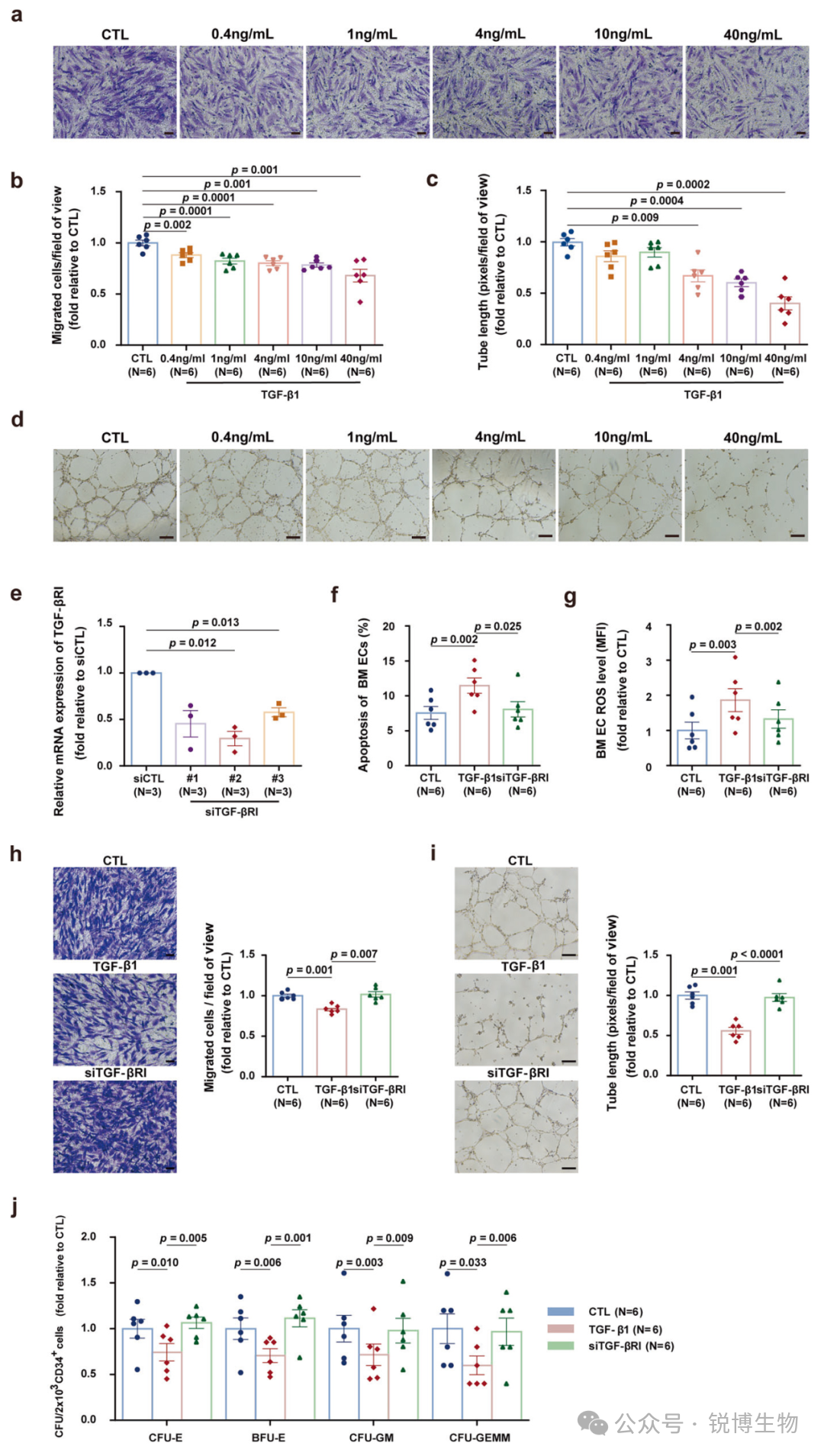
Fig1. TGF-β1 激活会导致骨髓内皮细胞损伤
骨髓血管内皮细胞特异性激活TGF-β1通路可诱导其适应不良修复并延迟造血再生修复
基于前述体外研究的发现,研究人员进一步通过体内实验探讨TGF-β1通路在骨髓内皮细胞中的功能。他们构建了通过腺相关病毒(AAV)介导、利用Tie启动子结合骨髓原位注射实现骨髓血管内皮细胞特异性过表达持续活化型TGF-βRI的小鼠模型(AAV-TGF-βRI小鼠)。在稳态条件下,内皮细胞过表达持续激活型TGF-βRI的小鼠与对照组在各造血参数上未见差异。然而,在化疗诱导的的应激造血状态下,实验组小鼠表现出显著的外周血恢复延迟,骨髓中内皮细胞数量明显减少,血管结构受损的现象。同时伴随着造血干祖细胞及各系髓系祖细胞比例的显著下降。证实了在应激条件下,TGF-β1通路的持续激活会介导骨髓内皮细胞发生适应不良性修复,导致血管结构破坏,进而损害造血恢复过程。经过化疗后的AAV-TGF-βRI小鼠在使用LY2157299(TGF-βRI激酶抑制剂)干预后,可观察到外周血细胞的恢复、骨髓血管内皮细胞数量的增加以及血管结构得到改善,骨髓中的造血干祖细胞和髓系祖细胞比例也显著回升,为相关治疗策略的开发提供了有力的实验依据。
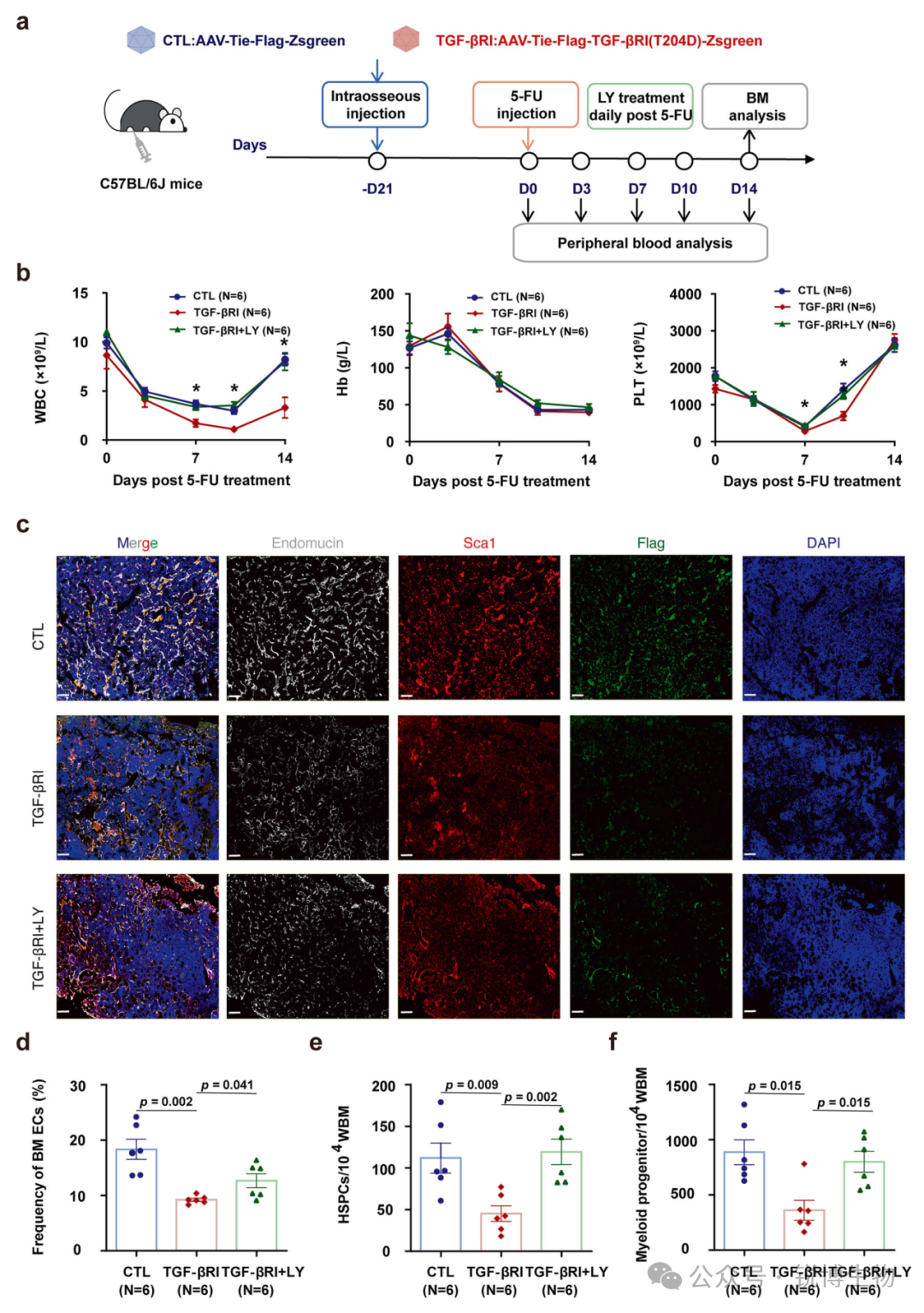
Fig2. 在骨髓内皮细胞中过度表达TGF-βRI加剧内皮损伤并延迟小鼠的造血恢复
多组学整合分析揭示TGF-β1驱动骨髓血管内皮细胞适应不良修复的分子机制
为从机制上阐明在体内外观察到的内皮细胞适应不良修复表型与TGF-β1信号的关系,研究人员进行了整合性的转录组学和磷酸化蛋白质组学分析。
转录组学:TGF-β1刺激导致骨髓血管内皮细胞的基因表达发生显著重编程。
对经TGF-β1处理的骨髓内皮细胞的RNA测序结果进行富集分析,下调基因主要关联于细胞对生长因子刺激的响应、细胞运动、血管生成、造血及细胞生长等关键内皮功能。包含多种关键的造血调控因子,造血干细胞再生的关键调控因子多效生长素(PTN)下调最为显著。反之,与适应不良重塑相关的通路,如上皮-间质转化、糖酵解、G2M检查点和未折叠蛋白反应则显著上调。
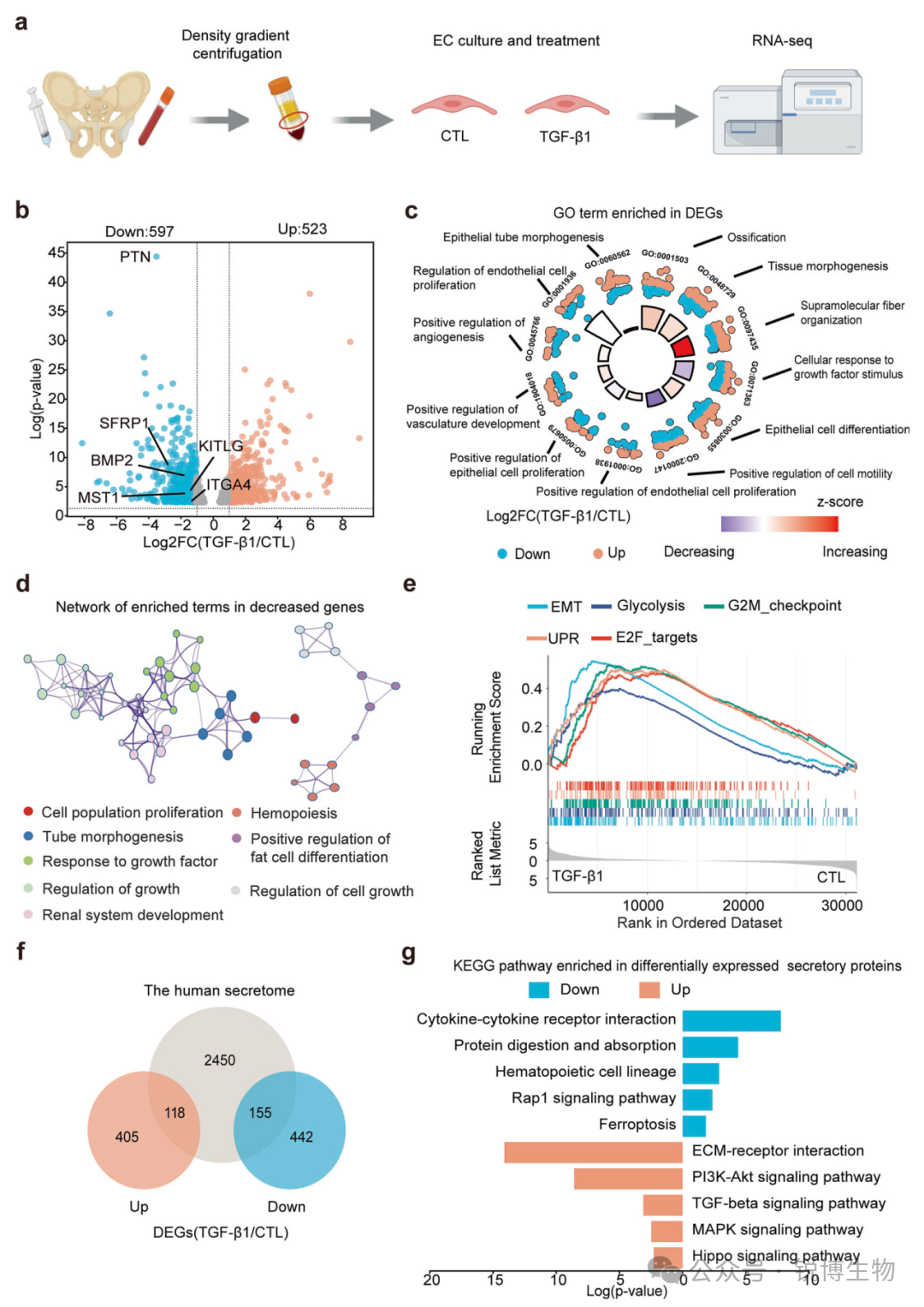
Fig3. RNA-seq 分析显示,TGF-β1 处理会引起骨髓内皮细胞(BM ECs)分泌组的变化
为了研究分泌组失调与内皮损伤之间的因果关系,研究人员将重点放在了PTN上——被RNA-seq确定的TGF-β1处理的BM EC中最显着下调的基因。qPCR验证证实,TGF-β1处理显著抑制PTN表达,而TGF-βRI抑制剂LY2157299(LY)则可逆转这一抑制。在TGF-β1处理的细胞中分别加入LY或重组PTN进行干预。两种处理均能有效恢复内皮细胞数量,其双染色阳性细胞比例显著回升。并且,LY处理与PTN补充均可恢复骨髓血管内皮细胞的吞噬、迁移、成管能力及其造血支持功能。
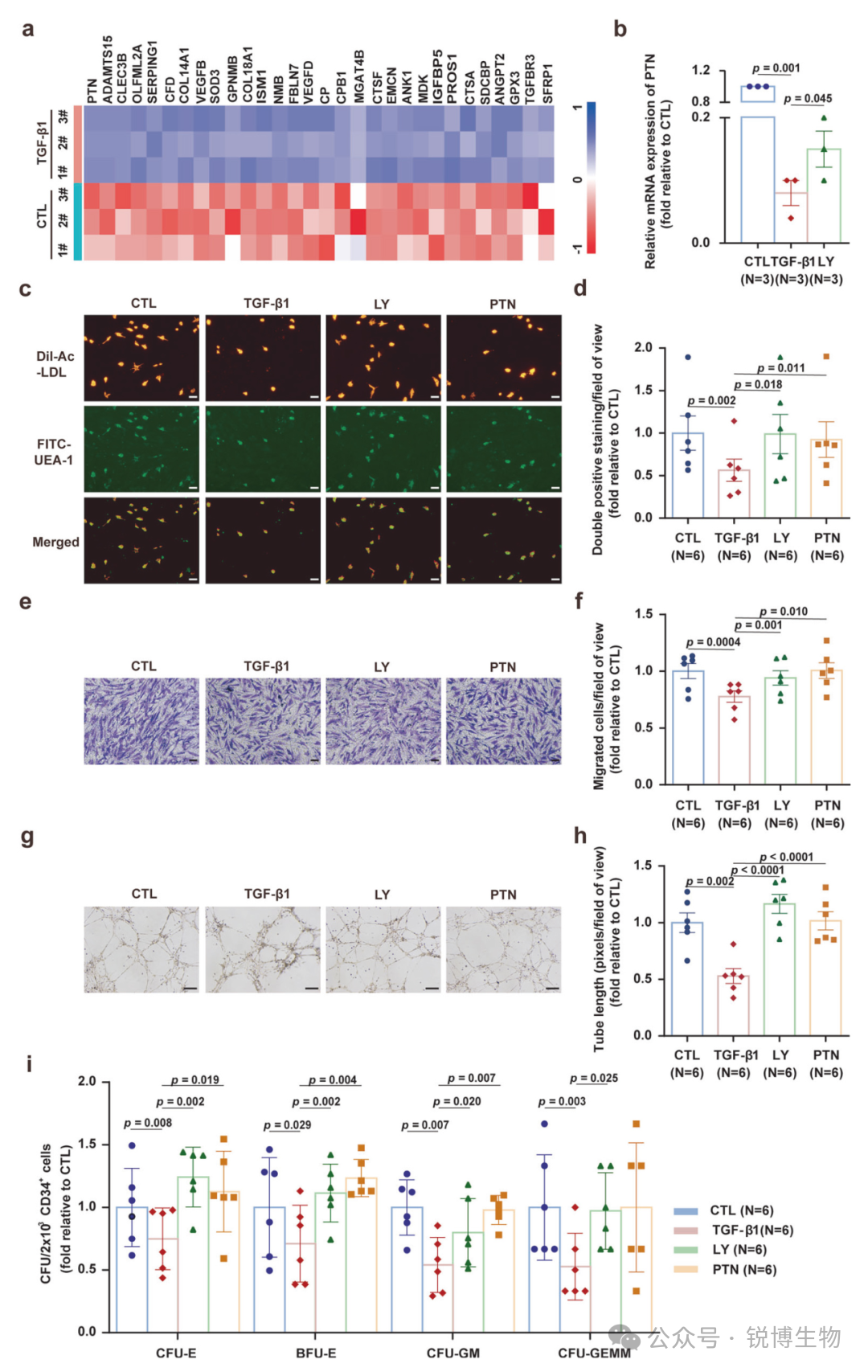
Fig4. 无论是抑制 TGF-β1 通路,还是使用 HSC 活性血管分泌因子多能素 (PTN) 治疗,都可以在体外修复不适应性的骨髓内皮细胞 (BM ECs)
磷酸化蛋白质组学:动态磷酸化分析揭示了TGF-β1刺激下信号网络的时序性重塑。
通过时间分辨磷酸化蛋白质组学分析,发现TGF-β1的持续激活破坏了VEGF信号与Notch信号这两个维持血管稳态的关键通路之间的正常对话,同时驱动了p38 MAPK的持续活化。Notch通路调控蛋白NUMB和小窝蛋白Cavin-1呈现磷酸化水平下降,这种差异化的磷酸化修饰可能通过影响VEGFR2/VEGFR3的活性,进而激活PI3K/AKT和MAPK通路并促进上皮-间质转化。这些发现共同揭示了TGF-β1通过扰乱VEGFR/Notch信号交叉对话并激活p38α,从而损害内皮修复和生态位功能的分子机制。
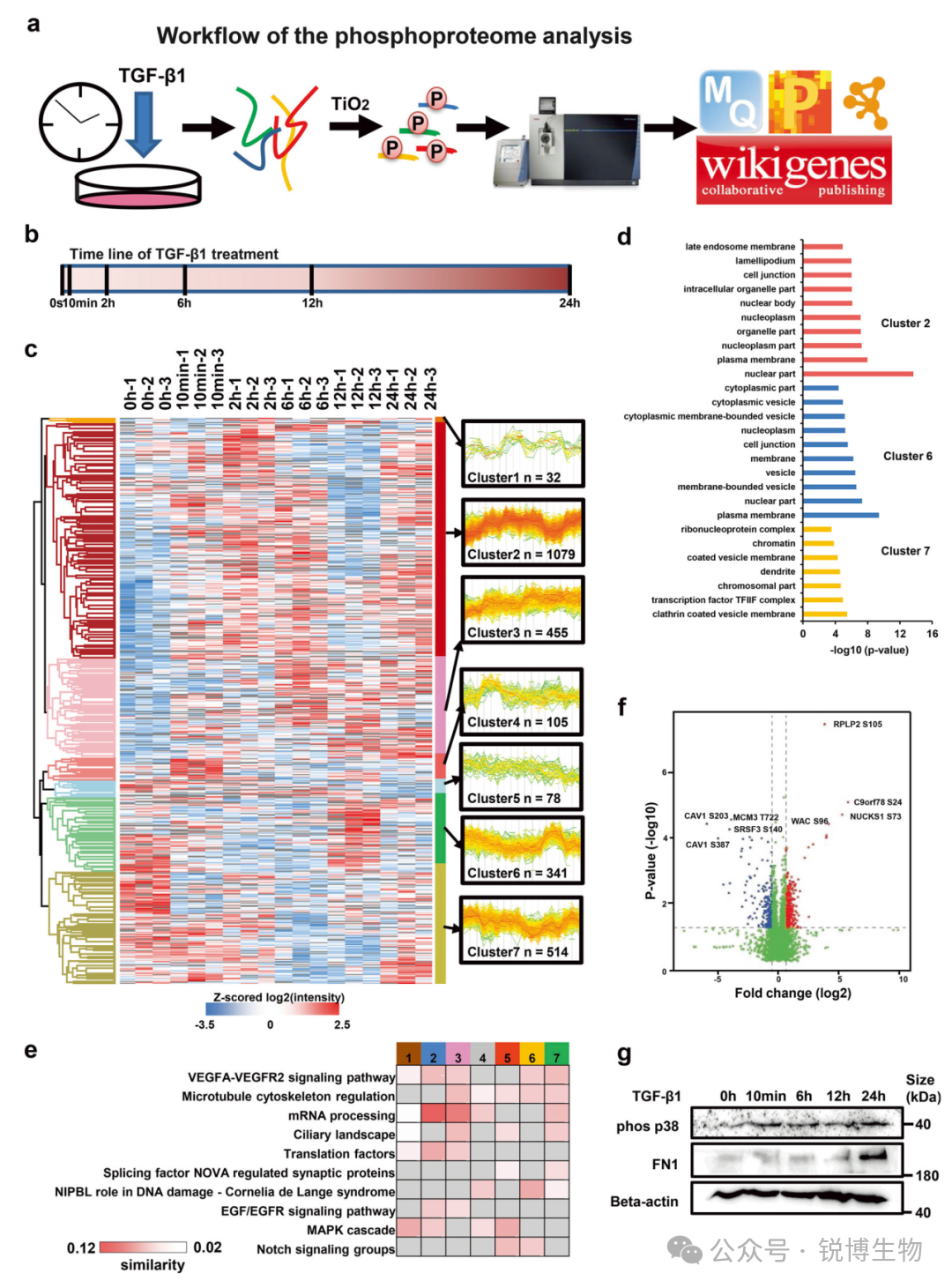
Fig5. TGF-β1调控的磷酸化事件的时间解析
临床转化价值:移植后植入功能不良患者的骨髓血管内皮细胞TGF-β1通路蛋白表达显著增高。
基于前述研究基础,研究人员进一步在移植后PGF患者骨髓内皮细胞中探讨TGF-β1信号的作用。RNA测序分析显示,与造血功能良好的GGF患者相比,PGF患者骨髓内皮细胞中TGF-β1信号通路的关键组分(包括TGF-β1配体、TGF-βRI及其下游效应分子)均显著上调。基因集富集分析进一步证实,PGF患者内皮细胞中TGF-β驱动的上皮-间质转化通路明显激活。利用流式细胞术检测发现PGF患者骨髓内皮细胞内TGF-β1和TGF-βRI的表达水平确实显著高于GGF对照组。这些临床样本数据证实,TGF-β信号通路在PGF患者骨髓内皮细胞中被异常激活。
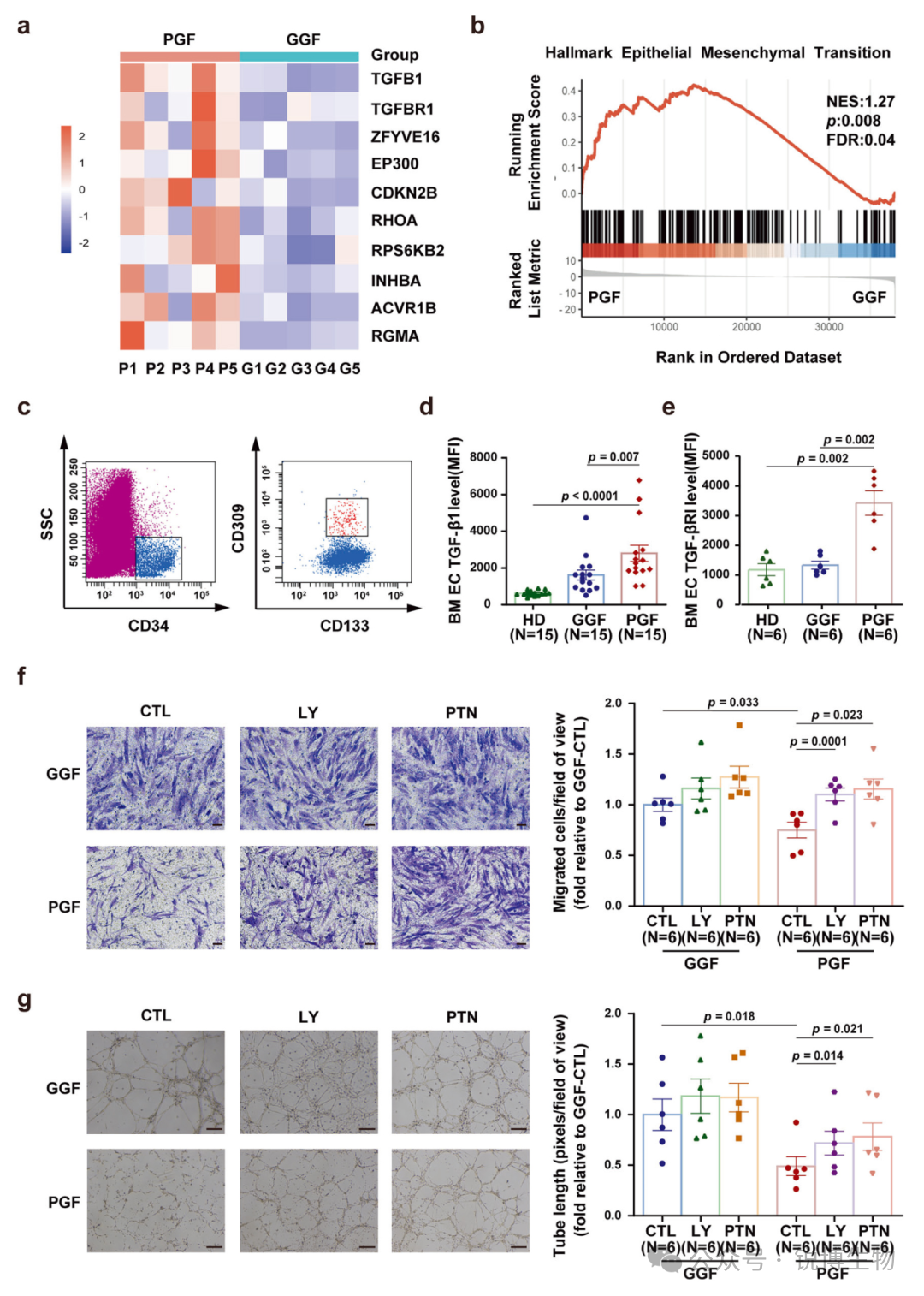
Fig6. 来自PGF患者的骨髓内皮细胞中TGF-β1通路过度活跃
基于这些发现,研究人员开展了一项前瞻性临床试验,去评估TGF-β配体陷阱药物Luspatercept对移植后造血重建不良患者的治疗效果。结果显示,在接受治疗的64例患者中,红系造血改善应答率为35.9%。在治疗有效的患者中,69.6%的患者中性粒细胞显著提升,47.8%的患者血小板计数明显改善。在首次给药后第20天,治疗应答者的血红蛋白浓度、中性粒细胞绝对值、血小板计数及白细胞计数均较治疗前显著提升,且未见严重不良反应。这项临床研究证实,Luspatercept能够安全有效地促进移植后患者的多系造血恢复,为治疗造血重建不良提供了新的治疗策略。
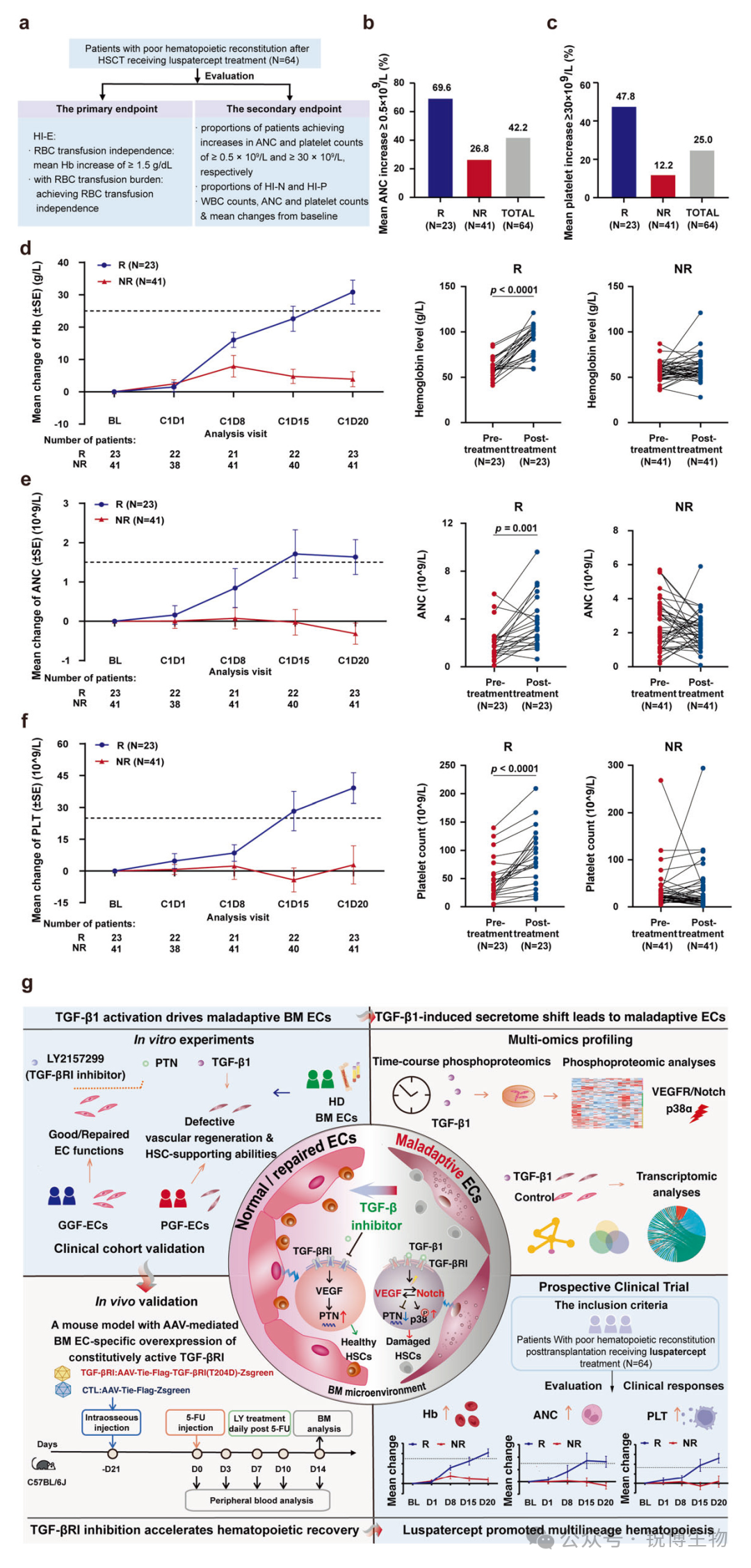
Fig7. Luspatercept在造血干细胞移植后血液重建不良患者中的临床评估
锐博生物siRNA研究科研服务及产品
锐博生物具有20多年siRNA设计和合成经验,建立了国际标准生产车间,创新性地推出了常规siRNA、单基因siRNA套装、动物用siRNA、siRNA文库、siRNA对照等一系列产品,每一个交付的siRNA产品均经过严格的质检,产品质量符合或超过NMPA、ICHQ7等生产要求,可以根据不同的实验需求选择对应的产品。
产品类别
❑ 常规siRNA:稳定沉默,适用于细胞实验,广泛用于基因功能研究;
❑ 单基因siRNA套装:超高性价比、售后无忧,可用于快速筛选出高效的siRNA;
❑ 动物用siRNA:采用独特化学修饰,活体沉默效果显著,主要用于动物模型的基因沉默实验;
❑ siRNA文库:效率革命、一击必中,适用于高通量基因功能筛选,能够一次性分析成百上千个基因,助力大规模基因研究;
❑ 定制型siRNA:量身定制,根据你的实验需求,量身定制siRNA序列;
❑ siRNA对照:提供阴性对照siRNA、阳性对照siRNA、荧光转染对照siRNA,为RNAi沉默实验保驾护航。