推荐产品
公司新闻/正文
lncRNA研究进展盘点丨20231222期
人阅读 发布时间:2023-12-22 15:42
LncRNA LY6E-DT and its encoded metastatic-related protein play oncogenic roles via different pathways and promote breast cancer progression
LncRNA LY6E-DT及其编码的转移相关蛋白通过不同的途径发挥致癌作用,促进乳腺癌进展
发表期刊:Cell Death Differ
影响因子:12.4
发表时间:2023年12月19日
长链非编码RNA(lncRNA)异常表达在肿瘤侵袭和转移中起着重要作用。本研究发现lncRNA LY6E-DT(LY6E divergent transcript)水平在乳腺癌(BC)组织中的升高。转录因子SP3直接与LY6E-DT启动子结合,激活其转录。此外,METTL14对LY6E-DT的N6-甲基腺苷修饰依赖于“reader”IGF2BP1依赖性途径来促进LY6E-DT表达。值得注意的是,研究人员发现lncRNA LY6E-DT编码一种保守的153-aa蛋白,即“转移相关蛋白”(MRP)。LY6E-DT和MRP均促进BC的侵袭和转移,MRP表达可鉴别有淋巴结转移的BC患者和无淋巴结转移的BC患者。机制上,MRP结合异质核核糖核蛋白C1/C2(HNRNPC),增强HNRNPC与表皮生长因子受体(EGFR)mRNA之间的相互作用,增加EGFR mRNA的稳定性和蛋白表达,随后激活磷脂酰肌醇3-激酶/蛋白激酶B信号转导(PI3K)通路。LncRNA LY6E-DT促进Y box结合蛋白1(YBX1)与输入蛋白α1之间的相互作用,增加YBX1蛋白进入细胞核,转录激活锌指E-box结合同源盒1(ZEB1)。本研究结果揭示了由LY6E-DT及其编码的MRP协调的BC侵袭的新调控机制。
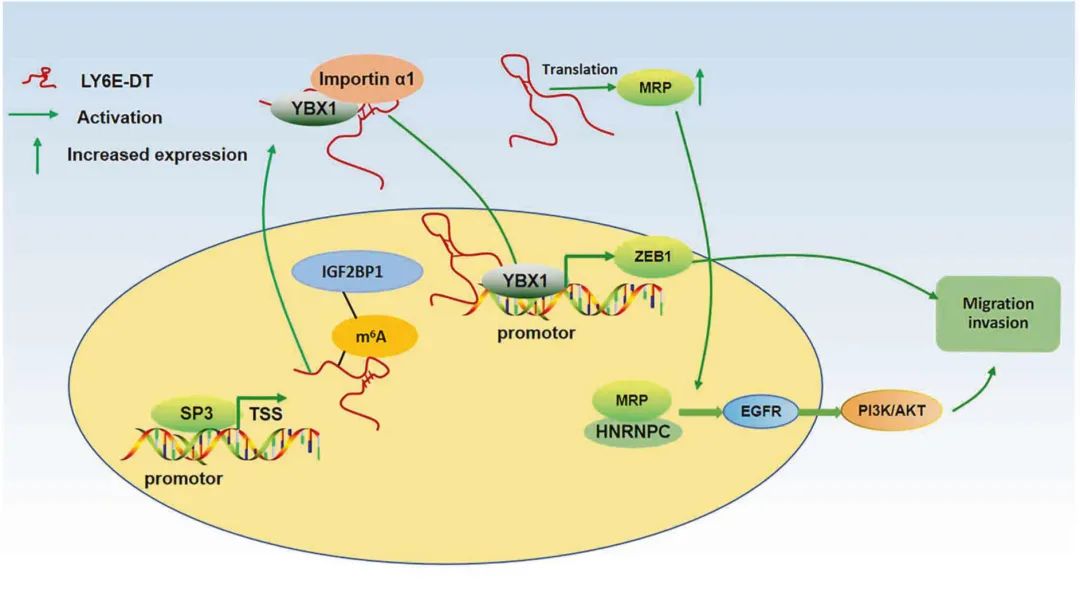
Fig1. LY6E-DT本身及其编码的蛋白质MRP在调节BC进展中的功能作用
原文链接:
https://pubmed.ncbi.nlm.nih.gov/38114778/
SNHG17 alters anaerobic glycolysis by resetting phosphorylation modification of PGK1 to foster pro-tumor macrophage formation in pancreatic ductal adenocarcinoma
SNHG17通过重置PGK1的磷酸化修饰来改变厌氧糖酵解,从而促进胰腺导管腺癌中促肿瘤巨噬细胞的形成
发表期刊:J Exp Clin Cancer Res
影响因子:11.3
发表时间:2023年12月15日
背景:在肿瘤免疫微环境(TME)中,肿瘤相关巨噬细胞(TAMs)在调节极化状态以通过代谢重编程影响癌症发展方面起着至关重要的作用。虽然长链非编码RNAs(lncRNAs)已被证明在各种癌症的进展中起着关键作用,但lncRNAs通过巨噬细胞代谢重塑改变M2极化的潜在机制仍未阐明。
结果:SNHG17在TAMs中显著富集,且与PDAC患者预后较差呈正相关。同时,功能实验确定SNHG17通过增强M2巨噬细胞极化和厌氧糖酵解促进PCs的恶性进展。机制上,SNHG17可以充当miR-628-5p海绵以释放PGK1 mRNA,并同时与PGK1蛋白相互作用,通过ERK1/2募集增强PGK1 T168A位点的磷酸化,从而激活PGK1的促肿瘤功能。最后,SNHG17敲低可以逆转PDAC中巨噬细胞的极化状态。
结论:本研究阐明了SNHG17在PDAC来源的TAMs中的重要作用及其分子机制,表明SNHG17可能是PDAC免疫治疗的可行靶点。

Fig2. 研究模型示意图
原文链接:
https://pubmed.ncbi.nlm.nih.gov/38098044/
Super Enhancer–Regulated LncRNA LINC01089 Induces Alternative Splicing of DIAPH3 to Drive Hepatocellular Carcinoma Metastasis
超级增强子调节的 LncRNA LINC01089诱导DIAPH3可变剪接以驱动肝细胞癌转移
发表期刊:Cancer Res
影响因子:11.2
发表时间:2023年12月15日
肝细胞癌(HCC)是最致命的肿瘤之一,转移性疾病患者的5年生存率仅为18%。表观遗传修饰因子和改变,包括组蛋白修饰、长链非编码RNA(lncRNA)、RNA选择性剪接和N6-甲基腺苷(m6A)修饰,是HCC发展的关键调节因子,突出了了解这些生物过程之间的串扰的重要性。本研究将LINC01089鉴定为一种超级增强子(SE)驱动的 lncRNA,可在体内和体外促进HCC细胞的上皮-间充质转化(EMT)、迁移、侵袭和转移。转录因子E2F1与LINC01089 SE结合,促进LINC01089的转录和过表达。LINC01089与异质核核糖核蛋白M(hnRNPM)相互作用,导致hnRNPM介导的DIAPH3外显子3跳跃。敲低LINC01089增加了DIAPH3外显子3的内含,其中包含一个重要的m6A修饰位点,IGF2BP3可识别该位点以增加DIAPH3 mRNA 的稳定性。因此,LINC01089缺失增加了DIAPH3蛋白水平,从而抑制了ERK/Elk1/Snail轴并抑制了HCC细胞的EMT。总之,这项研究揭示了驱动HCC进展的不同表观遗传修饰因子和改变之间的串扰,并将LINC01089确定为HCC的潜在预后标志物和治疗靶点。

Fig3. SE驱动的L01089-hnRNPM-DIAPH3轴在HCC中的调节和功能的示意图
原文链接:
https://aacrjournals.org/cancerres/article-abstract/83/24/4080/731558/Super-Enhancer-Regulated-LncRNA-LINC01089-Induces?redirectedFrom=fulltext
Long non-coding RNAs - SNHG6 emerge as potential marker in colorectal cancer
长链非编码RNAs - SNHG6成为结直肠癌的潜在标志物
发表期刊:BBA Rev Cancer
影响因子:11.2
发表时间:2023年12月15日
结直肠癌(CRC)是西方国家发病率和死亡率最高的癌症之一。目前,没有足够的诊断标志物可以实现早期诊断和有效治疗。不幸的是,大量新的结直肠癌病例是在晚期发现的,并伴有远处转移,因此,迫切需要新的治疗方法,以缓解晚期结直肠癌的预后。SNHG6属于长链非编码RNAs组,这是一个由超过200个核苷酸组成的较大RNAs实体。SNHG6主要在细胞质中表达,在细胞质中它充当许多过程的调节因子:调节关键蛋白质枢纽;海绵化miRNA并上调其靶mRNA的表达;并与各种细胞通路相互作用,包括TGF-β/Smad和Wnt/β-catenin。SNHG6是一种致癌基因,与健康样本相比,在CRC组织和癌细胞系中显著过表达。其过表达与更高分级、淋巴血管浸润和肿瘤大小有关。考虑到SNHG6在结直肠肿瘤发生、侵袭和转移中的作用,本文总结了SNHG6在结直肠癌中的作用,并得出结论,SNHG6可以作为结直肠癌诊断和预后评估的潜在生物标志物。

Fig4. SNHG6在结直肠癌中的作用机制示意图
原文链接:
https://pubmed.ncbi.nlm.nih.gov/38104909/
LncRNA H19 inhibition impairs endoplasmic reticulum-mitochondria contact in hepatic cells and augments gluconeogenesis by increasing VDAC1 levels
LncRNA H19抑制损害了肝细胞中的内质网-线粒体接触,并通过增加VDAC1水平来增强糖异生
发表期刊:Redox Biol
影响因子:11.4
发表时间:2023年12月9日
尽管内质网(ER)和线粒体发挥着独立的细胞功能,但它们也在称为线粒体相关ER膜(MAMs)的特定位点物理连接,这些位点由几种拴系蛋白组成,这些蛋白在不同的细胞过程中发挥着不同的作用。然而,对细胞内这些拴系蛋白的调节研究相对较少。本研究发现,在糖尿病期间,肝脏中的几种MAM蛋白发生了显著变化,其中lncRNA H19调节VDAC1的水平。使用H19特异性siRNA抑制H19表达改变了Hepa 1-6细胞中的VDAC1、线粒体Ca2+和耗氧率、ATP和ROS水平,并增强了ER和线粒体偶联。虽然H19抑制不影响脂质积累,但糖异生基因水平显著增加。抑制H19可增加JNK磷酸化和IRS1-Ser307磷酸化,这与Hepa 1-6细胞中胰岛素刺激的AKT(Ser-473)磷酸化和葡萄糖摄取的消除有关。使用siRNA和二甲双胍抑制VDAC1的表达可显著挽救H19抑制的作用,而单独过表达VDAC1会产生与H19抑制相似的作用,表明VDAC1的增加介导了H19的不良反应。使用特异性siRNA进行体内H19抑制可增加小鼠肝脏VDAC1、pJNK和pIRS1(Ser307)水平并降低AKT(Ser-473) 磷酸化。这些表明H19-VDAC1轴在糖尿病期间内质网-线粒体偶联和调节肝脏糖异生中的重要作用。

Fig5. 研究模型示意图
原文链接:
https://pubmed.ncbi.nlm.nih.gov/38100882/
Targeting ST8SIA6-AS1 counteracts KRASG12C inhibitor resistance through abolishing the reciprocal activation of PLK1/c-Myc signaling
靶向ST8SIA6-AS1通过消除PLK1/c-Myc信号的相互激活来抵消KRASG12C抑制剂的耐药性
发表期刊:Exp Hematol Oncol
影响因子:10.9
发表时间:2023年12月16日
背景:KRASG12C抑制剂(KRASG12Ci)AMG510和MRTX849在临床试验中显示出良好的疗效,并已被批准用于KRASG12C突变癌症的治疗。然而,与治疗相关的耐药性的出现限制了它们的长期潜力。本研究旨在确定关键介质并制定克服策略。
结果:KRASG12Ci可持续地降低应答细胞系的c-Myc水平,但在对KRASG12Ci具有固有或获得性耐药性的细胞系中则没有。PLK1激活有助于这种不依赖ERK的c-Myc稳定性,这反过来直接诱导PLK1转录,形成一个正反馈回路,并赋予对KRASG12Ci的抗性。本研究发现ST8SIA6-AS1在耐药细胞中显著上调,并促进KRASG12C突变癌症的增殖。ST8SIA6-AS1与Aurora激酶A(Aurora A)/PLK1结合并促进Aurora A介导的PLK1磷酸化。同时靶向KRA和ST8SIA6-AS1/PLK1信号可抑制ERK依赖性和非依赖性c-Myc表达,协同导致细胞死亡和肿瘤消退,并克服KRASG12Ci耐药性。
结论:本研究破译了ST8SIA6-AS1/PLK1/c-Myc轴对KRASG12Ci具有固有和获得性耐药性,并且代表了与KRASG12Ci联合治疗KRASG12C突变癌症的有希望的治疗靶点。

Fig6. 同时靶向ST8SIA6-AS1/PLK1/c-Myc轴与KRAS引起显著的KRASG12Ci耐药细胞死亡的机制示意图
原文链接:
https://pubmed.ncbi.nlm.nih.gov/38104151/