推荐产品
公司新闻/正文
lncRNA研究进展盘点丨20231009期
人阅读 发布时间:2023-10-09 09:08
01
LINC00922通过上调ETS1启动子的H3K27巴豆酰化引诱SIRT3促进结直肠癌的转移
发表期刊:Mol Cancer
影响因子:37.3
发表时间:2023年10月4日
背景:赖氨酸巴豆酰化(Kcr)在结直肠癌(CRC)组织中上调,而其具体作用仍不确定。本研究旨在阐明组蛋白H3赖氨酸27巴豆酰化(H3K27cr)在促进结直肠癌转移中的作用和机制。
结果:临床上,H3K27cr在转移性结直肠癌组织中表达上调,与晚期临床分期呈正相关。功能上,敲低LINC00922抑制了体外和体内CRC细胞的迁移。此外,补充NaCr通过恢复H3K27cr水平恢复了LINC00922稳定敲低细胞的迁移和侵袭水平。机制上,LINC00922通过H3K27cr介导的细胞粘附分子(CAMs)促进上皮细胞的侵袭和迁移。值得注意的是,LINC00922与sirtuin 3(SIRT3)蛋白相互作用并阻碍其与ETS1启动子区域的结合,导致该启动子区域中H3K27cr水平升高,并随后激活ETS1转录。
结论:本研究结果揭示了受LINC00922调节的H3K27cr在促进CRC转移方面的新调节功能。这一发现有助于更深入地理解组蛋白巴豆酰化在CRC转移过程中的作用。
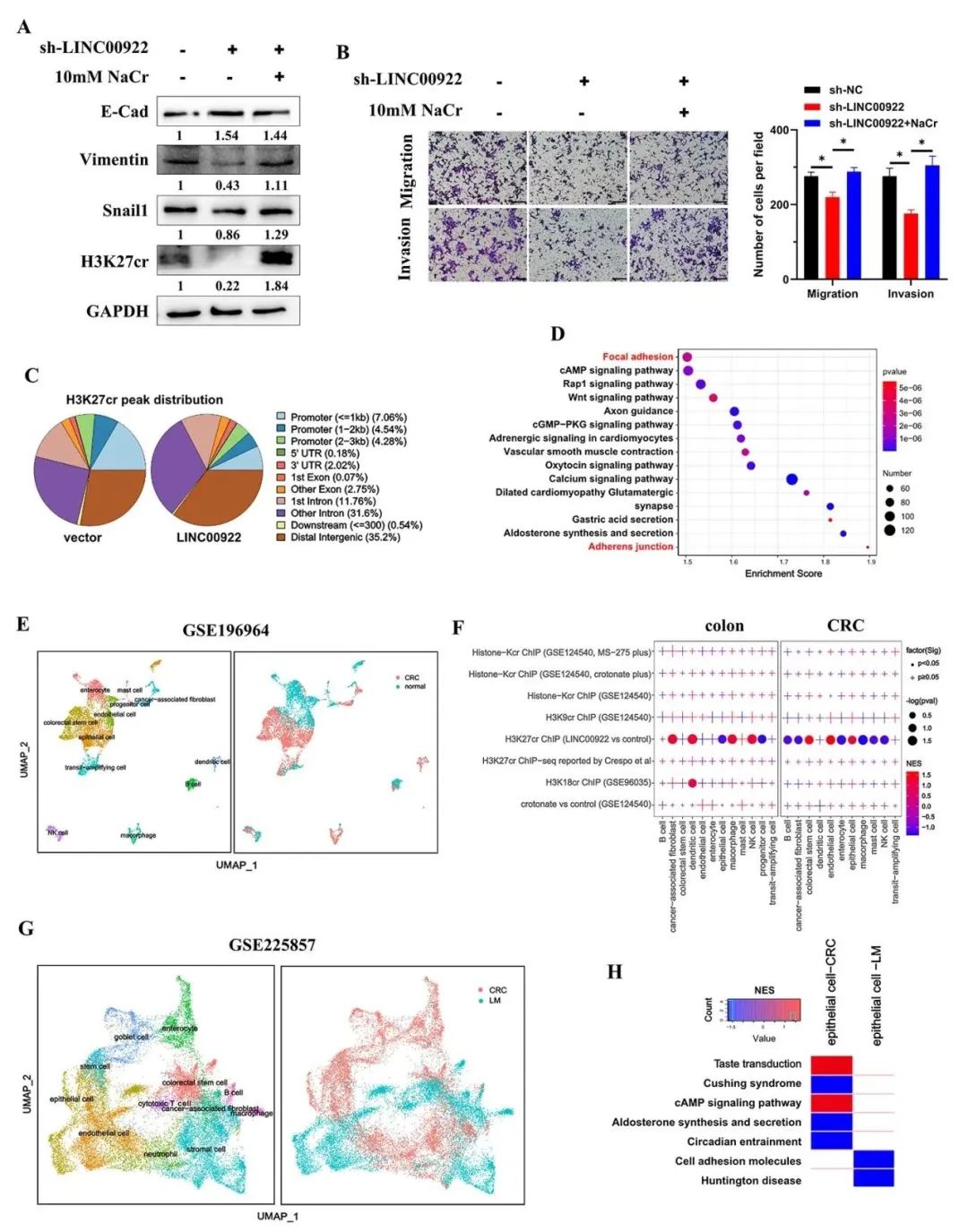
Fig1. LINC00922通过H3K27cr介导的CAMs促进上皮细胞的侵袭和迁移
原文链接:
https://molecular-cancer.biomedcentral.com/articles/10.1186/s12943-023-01859-y#Sec31
02
LncRNA EILA通过稳定cyclin E1蛋白促进CDK4/6抑制剂在乳腺癌中的耐药性
发表期刊:Sci Adv
影响因子:13.6
发表时间:2023年10月6日
CDK4/6抑制剂(CDK4/6i)加内分泌治疗现在是晚期HR+/HER2-乳腺癌的标准一线治疗,但对这些患者产生耐药性只是时间问题。本研究报道了cyclin E1相互作用的lncRNA(EILA)在CDK4/6i耐药乳腺癌细胞中上调,并通过稳定cyclin E1蛋白促进CDK4 / 6i耐药性。EILA过表达与乳腺癌细胞周期进展加快和预后不良相关。在体外和体内沉默EILA可降低cyclin E1蛋白并恢复CDK4/6i的敏感性。机制上,EILA的发夹A与cyclin E1蛋白的羧基末端结合并阻碍其与FBXW7的结合,从而阻止其泛素化和降解。EILA受CTCF/CDK8/TFII-I复合物的转录调节,并且可以被CDK8抑制剂抑制。本研究揭示了EILA在调节cyclin E1稳定性和CDK4/6i耐药性中的作用,这可能作为预测治疗反应的生物标志物和克服耐药性的潜在治疗靶点。

Fig2. EILA在体内促进CDK4/6抑制剂耐药性
原文链接:
https://pubmed.ncbi.nlm.nih.gov/37801505/
03
非编码snoRNA宿主基因是长链非编码RNAs的一个独特亚类
发表期刊:Trends Genet
影响因子:11.4
发表时间:2023年9月30日
哺乳动物基因组被普遍转录为不同的非编码(nc)RNA类别,每个类别都有自己的特征和例外。其中一些是相互嵌套的,例如小核仁RNAs(snoRNAs)的宿主基因,长期以来人们认为它们只是作为严格促进snoRNA生物发生的分子容器。然而,最近的研究结果表明,非编码snoRNA宿主基因(ncSNHGs)表现出与“常规”长链ncRNA(lncRNA)不同的特征,更重要的是,它们可以发挥与编码的snoRNAs非依赖性且不相关的功能。本文回顾和总结了过去和最近的证据表明ncSNHGs在众多lncRNAs中形成了一个明确的亚类,并讨论了可以进一步阐明其生物学相关性的未来研究。

Fig3. 基于功能元件的长链非编码(lnc)RNAs的分类
原文链接:
https://pubmed.ncbi.nlm.nih.gov/37783604/
04
ATR结合的lncRNA ScaRNA2通过在同源重组修复过程中促进有效的DNA末端切除来促进癌症耐药性
发表期刊:J Exp Clin Cancer Res
影响因子:11.3
发表时间:2023年9月30日
背景:之前的研究首先表明,ATR结合长链非编码RNA(lncRNA)是ATR功能所必需的,并促进了ATR的抗癌性。然而,在ATR激活中起作用的特定lncRNAs在很大程度上仍不清楚,这限制了我们对这一关键生物过程的全面理解。
结果:ScaRNA2被鉴定为富集最多的ATR结合lncRNA,并且被发现对同源重组(HR)介导的DNA损伤修复至关重要。此外,scaRNA2敲低消除了ATR及其底物的募集以响应DNA损伤。机制上,scaRNA2是Exo1介导的DNA末端切除所必需的,并将MRN复合物桥接到ATR活化。敲低scaRNA2有效提高了癌细胞对多种DNA损伤相关放化疗的敏感性。临床前,敲低scaRNA2改善了放疗对患者来源类器官和异种移植模型的影响。最后,在对放疗耐药的临床患者中也发现scaRNA2与ATR共定位的增加。
结论:ScaRNA2被鉴定为与ATR结合的最丰富的lncRNA,并被证明可以桥接DNA末端切除与ATR活化;因此,它可以用作癌症治疗与放化疗联合治疗的有效靶标。

Fig4. scaRNA2通过促进DNA末端切除来调节DNA损伤修复和癌症耐药性的机制模型示意图
原文链接:
https://pubmed.ncbi.nlm.nih.gov/37775817/
05
LncRNA SPRY4-IT1通过DUSP6-ERK1/2-Chk1信号通路调控颗粒物诱导的16HBE细胞恶性转化
发表期刊:Chemosphere
影响因子:8.8
发表时间:2023年10月3日
颗粒物(PM)是最严重的空气污染物之一,很容易通过气道并沉积在深肺泡中。因此,它可能会引发人类的炎症、哮喘和肺癌等呼吸系统疾病。长链非编码RNAs(lncRNAs)被认为是促进和进展多种癌症的重要调节因子。然而,lncRNAs介导PM诱导的肺癌发生的分子机制尚不清楚。本研究建立了PM诱导的16HBE恶性转化细胞(细胞用20μg/ml PM处理,命名为PM-T细胞),并探讨了lncRNAs在PM诱导的恶性转化中的作用和机制。与16HBE细胞相比,PM-T细胞中的各种生物学功能发生了变化,如细胞增殖、迁移、细胞周期和细胞凋亡。LncRNA SPRY4-IT1表达显著下调,并与这些生物学效应相关。本研究结果表明,lncRNA SPRY4-IT1过表达逆转了上述这些功能变化。进一步的研究表明,lncRNA SPRY4-IT1通过DUSP6-ERK1/2的负调控来调节Chk1表达,从而参与PM诱导的细胞转化。综上所述,本研究揭示了lncRNA SPRY4-IT1发挥肿瘤抑制基因的作用,可能通过调控DUSP6-ERK1/2-Chk1信号通路介导PM诱导的16HBE细胞恶性转化。

Fig5. 研究模型示意图
原文链接:
https://pubmed.ncbi.nlm.nih.gov/37797900/