推荐产品
公司新闻/正文
lncRNA研究进展盘点丨20220929期
人阅读 发布时间:2022-10-14 11:09
LncRNA PSR通过编码一种新型蛋白质Arteridin调节血管重塑
发表期刊:Circ Res
影响因子:23.213
发表时间:2022年9月22日
背景:血管平滑肌细胞(VSMCs)表型从收缩表型转变为增殖表型是各种心血管疾病的病理标志。最近,长链非编码RNAs的一个子集被鉴定出可产生功能性多肽。然而,长链非编码RNAs在VSMCs表型转换中的功能影响和调控机制仍有待充分阐明。本研究旨在探讨VSMC富集的长链非编码RNA及其编码肽在VSMC表型转换和血管重塑中的生物学功能和机制。
结果:本研究鉴定了一个VSMC富集的转录本,该转录本由一个以前未表征的基因编码,称之为表型转换调节因子(PSR),其在血管重塑过程中显著上调。尽管PSR被注释为长链非编码RNA,但本研究证明了lncPSR也编码一种蛋白质,将其命名为arteridin。在VSMCs中,arteridin和lncPSR都是诱导表型转换的必要和充分条件。机制上,arteridin和lncPSR通过直接与转录因子YBX1(Y-box结合蛋白1)相互作用并调节其核易位和染色质靶向来调节下游基因。有趣的是,arteridin也强烈诱导了PSR转录。更重要的是,PSR基因或arteridin蛋白的缺失显著减弱了颈动脉损伤引起的血管重构。此外,使用腺相关病毒对lncPSR的VSMC特异性抑制减弱了Ang II(血管紧张素II)诱导的高血压血管重塑。
结论:PSR是一个VSMC富集的基因,其编码的转录本(lncPSR)和蛋白质(arteridin)通过一个共享的相互作用伙伴YBX1协同调节转录重编程。这是一个先前未表征的、血管重塑过程中VSMC表型转换的调节回路,lncPSR/arteridin是治疗VSMC表型转换相关血管重塑的潜在治疗靶点。
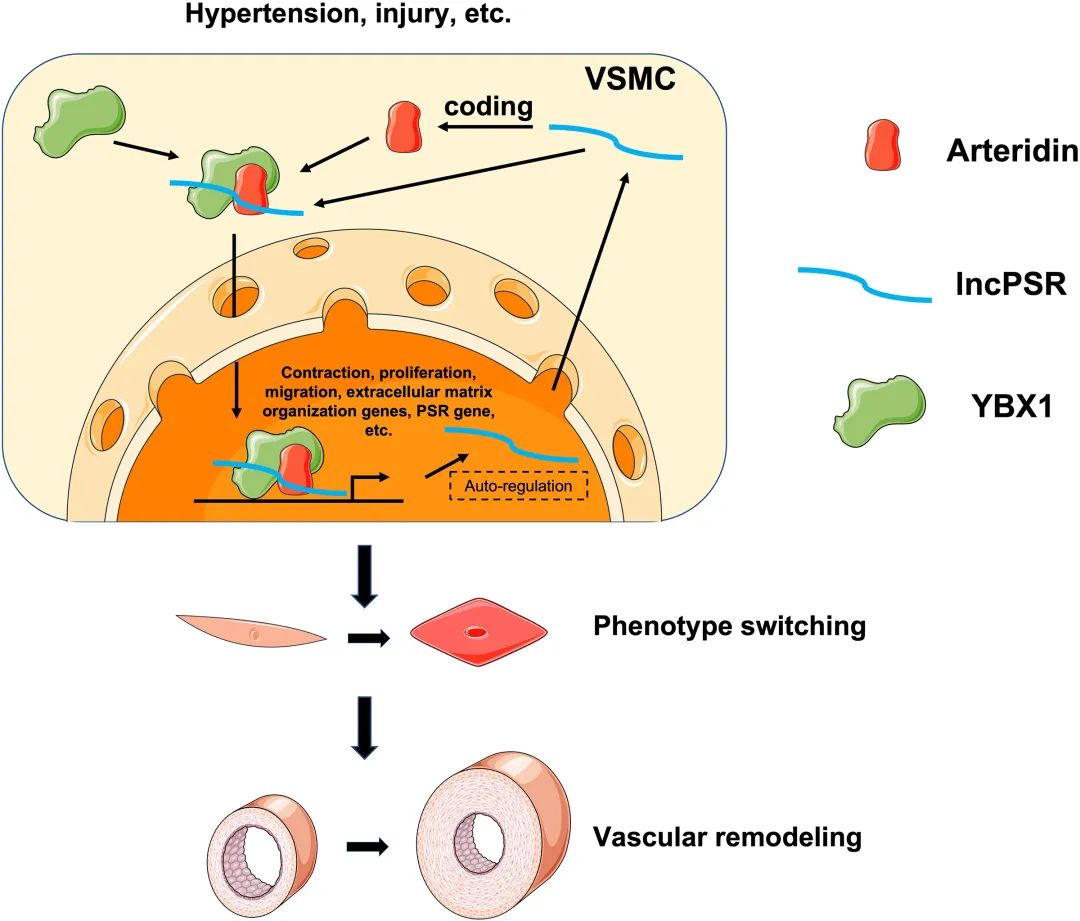
Fig1. 研究模型示意图
原文链接:
https://pubmed.ncbi.nlm.nih.gov/36134578/
LncRNA-Smad7介导Nodal/TGF-β和BMP信号之间的交互作用以调节多能和专能细胞的细胞命运决定
发表期刊:Nucleic Acids Res
影响因子:19.160
发表时间:2022年9月22日
转化生长因子β(TGF-β)超家族蛋白是细胞发育和分化的有效调节因子。Nodal/Activin/TGF-β和BMP配体在早期发育过程中都存在于细胞内和细胞外环境中,这两个发育信号分支之间的交互作用是目前研究的热点。本研究表明,Nodal诱导的lncRNA-Smad7通过抑制小鼠胚胎干细胞(mESCs)中的BMP信号通路来调节细胞命运决定。lncRNA-Smad7的缺失显著损害了mESCs中的心肌细胞分化。此外,lncRNA-Smad7通过(CA)12重复序列与Bmp2启动子区域结合形成一个R-loop,从而抑制Bmp2表达。重要的是,Bmp2敲低挽救了由lncRNA-Smad7敲低诱导的心肌细胞分化缺陷。因此,lncRNA-Smad7在mESCs中拮抗BMP信号传导,并类似地调节C2C12小鼠成肌细胞中骨细胞和肌细胞形成之间的细胞命运决定。此外,在mESCs中,lncRNA-Smad7与hnRNPK结合,并且hnRNPK结合在Bmp2启动子处,可能有助于抑制Bmp2的表达。本研究通过lncRNA-Smad7描述了Nodal/TGF-β和BMP信号之间的拮抗作用,为理解早期发育中的细胞命运决定提供了一个框架。

Fig2. lncRNA-Smad7在TGF-β和BMP信号串扰调控中的工作模型
原文链接:
https://pubmed.ncbi.nlm.nih.gov/36134711/
MIR17HG衍生的长链非编码RNA为蛋白质相互作用和骨髓瘤生长提供了必要的染色质支架
发表期刊:Blood
影响因子:25.476
发表时间:2022年9月20日
长链非编码RNAs(lncRNAs)可以驱动肿瘤发生,并且容易受到治疗干预的影响。本研究使用大规模的CRISPR干扰活性筛选来探索多发性骨髓瘤(MM)中细胞生长对lncRNA基因的依赖性,并确定了miR-17-92簇宿主基因(MIR17HG)的重要作用。结果发现了一个MIR17HG衍生的lncRNA lnc-17-92,它是细胞生长依赖性的主要介质,以microRNA和DROSHA非依赖性方式起作用。Lnc-17-92为c-MYC和WDR82之间的功能相互作用提供染色质支架,从而促进ACACA的表达,ACCAA编码新生脂肪生成乙酰辅酶A羧化酶1(ACC1)的限速酶。用临床适用的反义分子靶向MIR17HG pre-RNA会破坏lnc-17-92的转录和功能活性,在三种临床前动物模型(包括临床相关的PDX-NSG小鼠模型)中产生体外和体内强大的抗肿瘤作用。该研究确定了MIR17HG的一种新的致癌功能,并为转化为临床试验提供了有效的抑制剂。

Fig3. MIR17HG的治疗性抑制剂在人MM动物模型体内外均发挥有效的抗肿瘤活性
原文链接:
https://pubmed.ncbi.nlm.nih.gov/36126301/
TGFB2-AS1通过与SMARCA4相互作用并调节其靶标TGFB2和SOX2来抑制三阴性乳腺癌的进展
发表期刊:PNAS
影响因子:12.779
发表时间:2022年9月20日
三阴性乳腺癌(TNBC)是最具挑战性的乳腺癌亚型,其复发率高,转移潜力大,总生存期短。癌细胞是如何通过将非癌干细胞样细胞转化为具有干细胞特性的癌细胞来获得转移效力的,目前还尚不清楚。本研究将长链非编码RNA(lncRNA)TGFB2-AS1鉴定为TNBC中非癌干细胞群可逆性和可塑性的重要调节因子。研究发现TGFB2-AS1在体外会损害TNBC细胞的乳腺癌干细胞样细胞(BCSC)特征,并在体内显著降低致瘤频率和肺转移。机制上,TGFB2-AS1与SWI/SNF染色质重塑复合物的核心亚基SMARCA4相互作用,导致其靶基因(包括TGFB2和SOX2)以顺式或反式方式转录抑制,从而抑制转化生长因子β(TGFβ)信号和BCSC特征。与此一致,TGFB2-AS1在原位TNBC小鼠模型中的过表达显著消除了TGFβ2赋予的肿瘤生长和肺转移的增强作用。此外,TGFB2-AS1和TGFβ2在TNBC患者中的联合预后分析表明,高TGFB2-AS1和低TGFβ2水平与更好的预后相关。这些发现证明了TGFB2-AS1基于改变TNBC的癌细胞命运在抑制TNBC疾病进展中的关键作用,并为TNBC患者的治疗提供了启示。

Fig4. TGFB2-AS1在抑制TNBC进展中的调节机制和作用示意图
原文链接:
https://pubmed.ncbi.nlm.nih.gov/36126099/
LncRNA SNHG1通过与HDAC1/2的相互作用调节成神经细胞瘤细胞命运
发表期刊:Cell Death Dis
影响因子:9.685
发表时间:2022年9月21日
小核仁RNA宿主基因1(SNHG1)是一种在不同肿瘤类型中异常表达的新型致癌长链非编码 RNA(lncRNA)。之前的研究发现高表达的SNHG1与成神经细胞瘤(NB)的不良预后和MYCN状态有关。然而,SNHG1在NB中的分子机制仍不清楚。本研究使用CRISPR/Cas9系统破坏了MYCN扩增的NB细胞系SK-N-BE(2)C中的内源性SNHG1,并证明了SNHG1敲低细胞的增殖和集落形成能力受到抑制。SNHG1敲低细胞的转录组分析和功能测定表明,SNHG1参与了多种生物过程,包括细胞生长、迁移、凋亡、细胞周期和活性氧(ROS)。有趣的是,在SNHG1敲低的细胞中,MYCN扩增的NB中核心调节电路(CRC)转录因子的表达均降低,包括PHOX2B、HAND2、GATA3、ISL1、TBX1和MYCN。染色质免疫沉淀测序(ChIP-seq)和转座酶可及染色质测序(ATAC-seq)分析表明,这些CRC成员的染色质状态发生了改变,这可能是由于SNHG1和HDAC1/2之间的相互作用。这些发现表明,SNHG1通过染色质调控在维持NB同一性中发挥着至关重要的作用,并揭示了lncRNA SNHG1在NB中的功能。

Fig5. SNHG1介导MYCN扩增的成神经细胞瘤细胞的机制模型示意图
原文链接:
https://pubmed.ncbi.nlm.nih.gov/36130928/