推荐产品
公司新闻/正文
lncRNA研究进展盘点(20220712)
人阅读 发布时间:2022-07-12 09:15
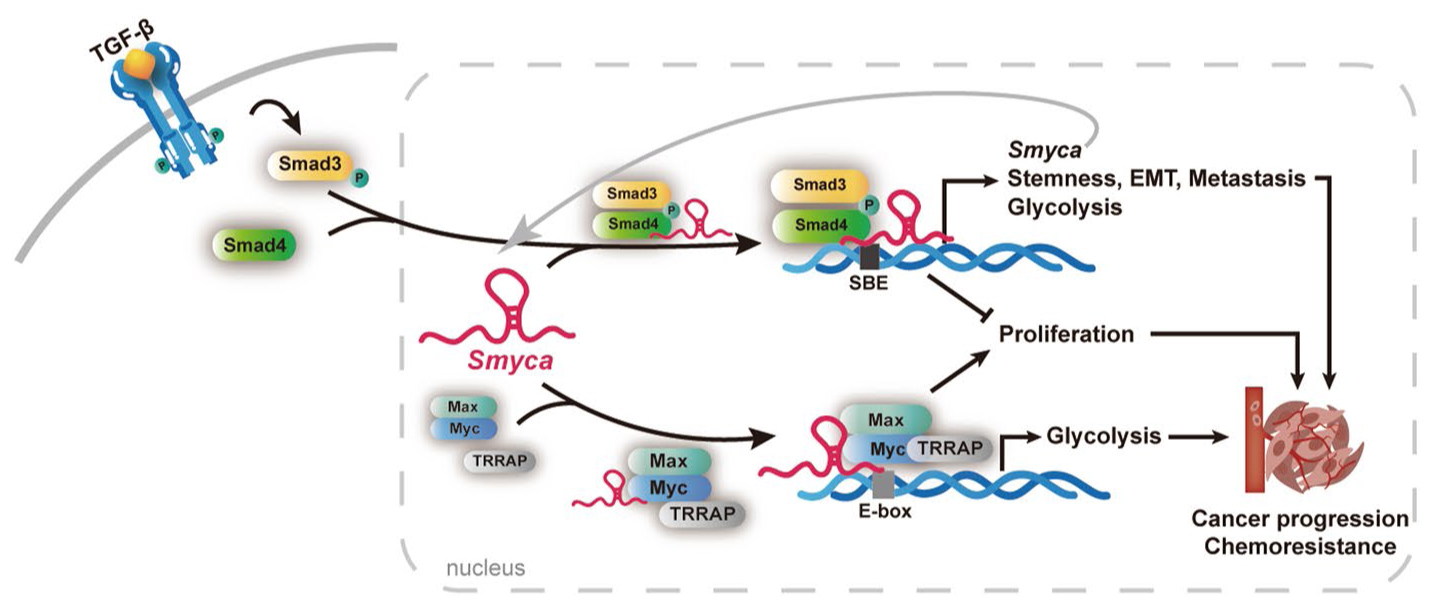
Long noncoding RNA Smyca coactivates TGF-β/Smad and Myc pathways to drive tumor progression
长链非编码RNA Smyca共激活TGF-β/Smad和Myc通路以驱动肿瘤进展
发表期刊:J Hematol Oncol
影响因子:23.168
发表时间:2022年7月6日
背景:转移和化疗耐药是导致癌症死亡的主要原因,但促成这些过程的因素尚不完全清楚。
结果:本研究确定lncRNA Smyca与许多癌症类型的不良预后相关。Smyca可增强代谢重编程、迁移、侵袭、癌症干性、转移和化疗耐药。机制上,Smyca通过充当促进Smad3/Smad4结合的支架来增强TGF-β/Smad信号通路,并进一步充当Smad靶标以放大/延长TGF-β信号通路。此外,Smyca通过增强c-Myc/Max复合物向一组靶标启动子的募集,以及c-Myc与TRRAP的结合来增强c-Myc介导的转录。通过增强TGF-β和c-Myc通路,Smyca可协同两种通路引发的Warburg效应,但避开TGF-β的抗增殖作用。靶向Smyca可防止转移并克服化疗耐药性。
结论:本研究揭示了一种lncRNA,其可以协调肿瘤相关通路以协调促肿瘤程序,并确定了Smyca在癌症预后和治疗中的临床价值。
原文链接:https://pubmed.ncbi.nlm.nih.gov/35794621/
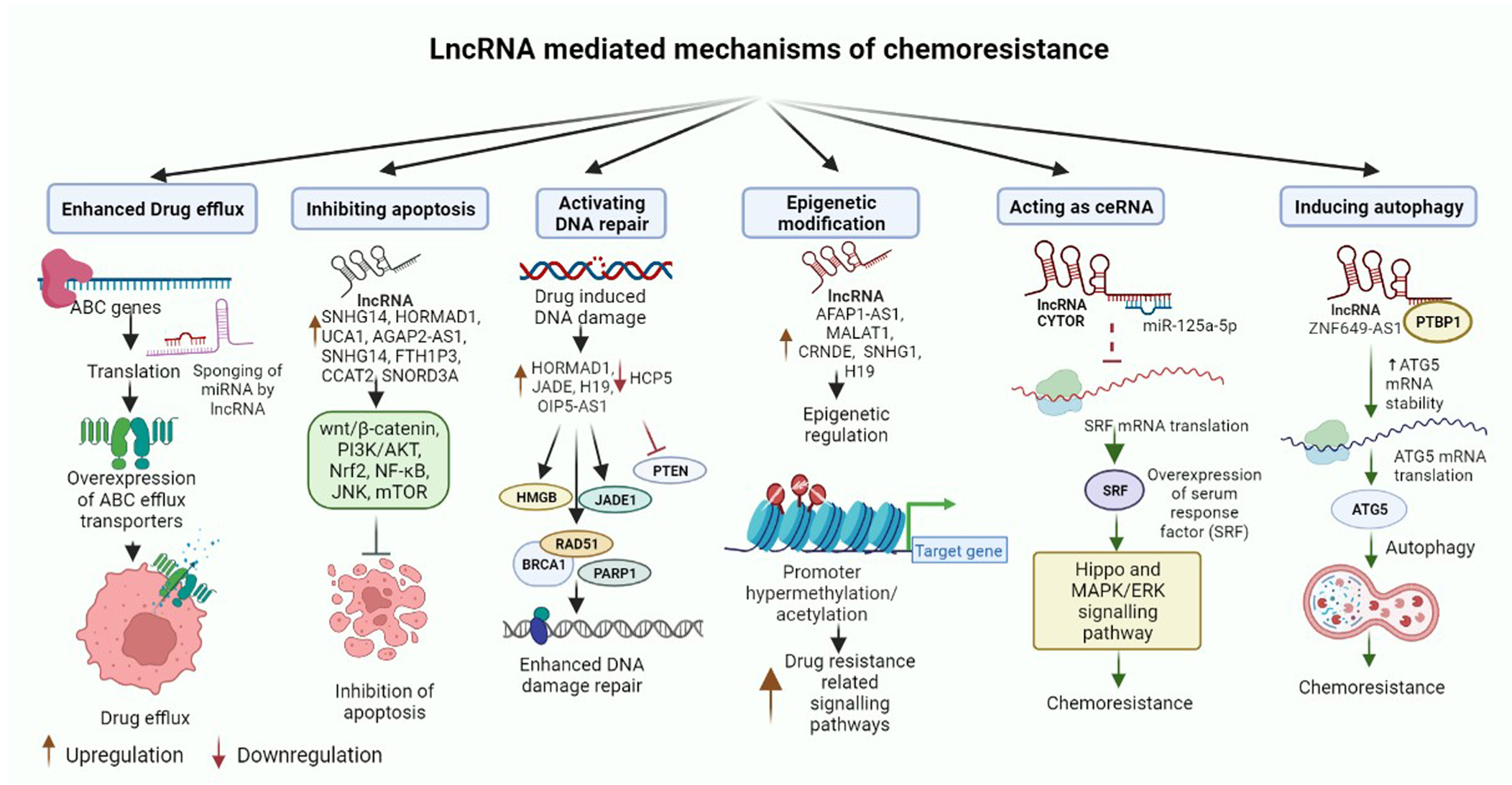
Long non-coding RNA mediated drug resistance in breast cancer
长链非编码RNA介导的乳腺癌耐药
发表期刊:Drug Resist Updat
影响因子:22.841
发表时间:2022年7月3日
乳腺癌是女性最常见的癌症之一,也是导致死亡的主要原因。根据2021年的GLOBCAN报告,乳腺癌已经超过了肺癌(直到最近它还是最常被诊断的癌症)。尽管为提高乳腺癌的早期发现和治疗效果做出了重大努力,但耐药性的频繁出现仍然是导致患有各种恶性肿瘤的癌症患者预后不良的主要原因。众所周知,长链非编码RNAs(lncRNAs)会影响基因组功能的多种组成部分,包括表观遗传学、基因转录、剪接、翻译,以及许多起支配作用的生物学过程,如细胞周期进程、细胞分化、发育和多能性。LncRNAs在各种恶性肿瘤中异常调节,并与多种RNAs和蛋白质相互作用以影响耐药性。LncRNAs通过多种分子机制调节癌症的化疗耐药,包括多药外排、抑制细胞凋亡、DNA损伤反应、表观遗传改变以及作为竞争性内源性RNA发挥作用。当与其他调节机制相结合时,这些通路形成了一个复杂的信号编排,最终导致化疗耐药。本综述就lncRNAs在诱导对用于治疗乳腺癌的常规治疗性抗癌药物产生耐药性中的作用进行了深入的探讨。作者提议,引起耐药性的lncRNAs可用于开发新的靶向和定制疗法,为引入有前景的个性化治疗方式以克服乳腺癌患者的化疗耐药性提供一种新的方法。因此,驱动抗癌药物耐药性的lncRNAs可以作为疾病预后的生物标志物进行探索,并可能提供独特的机会来规避乳腺癌患者的化疗耐药性。
原文链接:https://pubmed.ncbi.nlm.nih.gov/35810716/
A long noncoding RNA influences the choice of the X chromosome to be inactivated
长链非编码RNA影响X染色体失活的选择
发表期刊:PNAS
影响因子:12.779
发表时间:2022年7月12日
X染色体失活(XCI)是使雌性哺乳动物细胞中的一条X染色体沉默的过程,可确保两性之间的剂量补偿。尽管理论上在体细胞组织中是随机的,但选择哪一条X染色体被失活可能会因与所谓的X控制元件(Xce)相关的遗传元件而在小鼠中产生偏差。尽管Xce在近40年前首次被描述和基因定位,但其作用方式在很大程度上仍然不清楚。本研究在Xce基因座Lppnx中鉴定了一个长链非编码RNA (lncRNA),这可能是在发育的雌性小鼠胚胎中选择哪一条X染色体失活的驱动因子。通过比较弱和强Xce等位基因,研究人员发现Lppnx通过控制Xist Intron1处多能性因子的占有率来调节Xist lncRNA(XCI中的关键因子之一)的表达。在强而不是弱Xce等位基因中,这种效应被DxPas34中Rex1的增强结合所抵消,DxPas34是XCI中调节Tsix lncRNA活性的另一个关键元件,是Xist的主要拮抗剂。这些结果表明,在弱和强Xce等位基因中观察到的对XCI的不同易感性是由于Xist Intron 1和DxPas34的不同转录因子结合造成的,并且Lppnx代表了解释Xce作用的决定性因子。

原文链接:https://pubmed.ncbi.nlm.nih.gov/35787055/
Long noncoding RNA MAGI2-AS3 regulates the H2O2 level and cell senescence via HSPA8
长链非编码RNA MAGI2-AS3通过HSPA8调节H2O2水平和细胞衰老
发表期刊:Redox Biol
影响因子:10.787
发表时间:2022年6月30日
氧化还原稳态系统调节许多生物过程、细胞内抗氧化剂的产生和氧化还原信号。然而,长链非编码RNAs(lncRNAs)参与氧化还原调节的报道很少。本研究报道了MAGI2-AS3的下调降低了人类成纤维细胞(Fbs,一种复制性衰老模型)中的超氧化物水平。RNA pulldown结合质谱分析表明HSPA8是MAGI2-AS3的一种新型相互作用蛋白,通过PAR-CLIP进一步证实了这一结果。MAGI2-AS3的下调通过抑制HSPA8的蛋白酶体降解来稳定HSPA8蛋白水平,从而降低了过氧化氢(H2O2)的含量。进一步的证据表明,MAGI2-AS3与HSPA8的C末端结构域(CTD)相互作用。MAGI2-AS3的下调延迟了细胞衰老,而这种抗衰老作用可通过敲低HSPA8而被消除。MAGI2-AS3敲低抑制细胞衰老的潜在分子机制是通过抑制ROS/MAP2K6/p38信号通路介导的。总之,这些研究结果表明,lncRNA MAGI2-AS3的下调通过稳定HSPA8蛋白水平来降低H2O2含量并延迟了细胞衰老,从而表明了其具有潜在的抗衰老应用。

原文链接:https://pubmed.ncbi.nlm.nih.gov/35797800/
A novel lncRNA RP11-386G11.10 reprograms lipid metabolism to promote hepatocellular carcinoma progression
一种新型lncRNA RP11-386G11.10重编程脂质代谢以促进肝细胞癌进展
发表期刊:Mol Metab
影响因子:8.568
发表时间:2022年7月5日
越来越多的研究表明,包括脂质代谢重编程在内的代谢变化在肝细胞癌(HCC)的进展中发挥着重要作用。但长链非编码RNAs(lncRNAs)如何影响肿瘤细胞代谢仍有待阐明。通过对TCGA-LIHC数据集的分析和筛选,本研究发现一种新的lncRNA RP11-386G11.10在HCC中过表达,并且与HCC患者的肿瘤大小、TNM分期和预后不良呈正相关。机制上,RP11-386G11.10作为miR-345-3p的竞争性内源性RNA(ceRNA)来调节HNRNPU及其下游脂肪生成酶的表达,导致HCC细胞中的脂质积累。此外,本研究将ZBTB7A鉴定为RP11-386G11.10的转录因子。此外,HNRNPU促进了HCC细胞中ZBTB7A的表达,从而提高了RP11-386G11.10的转录活性,并形成正反馈回路,最终导致脂质持续积累。本研究结果表明lncRNA RP11-386G11.10是一种新型致癌lncRNA,与HCC的不良预后密切相关。ZBTB7A-RP11-386G11.10-miR-HNRNPU正反馈环通过调节脂质合成代谢促进HCC的进展。

原文链接:https://pubmed.ncbi.nlm.nih.gov/35798238/
长链非编码RNA Smyca共激活TGF-β/Smad和Myc通路以驱动肿瘤进展
发表期刊:J Hematol Oncol
影响因子:23.168
发表时间:2022年7月6日
背景:转移和化疗耐药是导致癌症死亡的主要原因,但促成这些过程的因素尚不完全清楚。
结果:本研究确定lncRNA Smyca与许多癌症类型的不良预后相关。Smyca可增强代谢重编程、迁移、侵袭、癌症干性、转移和化疗耐药。机制上,Smyca通过充当促进Smad3/Smad4结合的支架来增强TGF-β/Smad信号通路,并进一步充当Smad靶标以放大/延长TGF-β信号通路。此外,Smyca通过增强c-Myc/Max复合物向一组靶标启动子的募集,以及c-Myc与TRRAP的结合来增强c-Myc介导的转录。通过增强TGF-β和c-Myc通路,Smyca可协同两种通路引发的Warburg效应,但避开TGF-β的抗增殖作用。靶向Smyca可防止转移并克服化疗耐药性。
结论:本研究揭示了一种lncRNA,其可以协调肿瘤相关通路以协调促肿瘤程序,并确定了Smyca在癌症预后和治疗中的临床价值。

Fig1. Smyca在共激活TGF-β/Smad和Myc通路促进肿瘤进展中的作用示意图
原文链接:https://pubmed.ncbi.nlm.nih.gov/35794621/
Long non-coding RNA mediated drug resistance in breast cancer
长链非编码RNA介导的乳腺癌耐药
发表期刊:Drug Resist Updat
影响因子:22.841
发表时间:2022年7月3日
乳腺癌是女性最常见的癌症之一,也是导致死亡的主要原因。根据2021年的GLOBCAN报告,乳腺癌已经超过了肺癌(直到最近它还是最常被诊断的癌症)。尽管为提高乳腺癌的早期发现和治疗效果做出了重大努力,但耐药性的频繁出现仍然是导致患有各种恶性肿瘤的癌症患者预后不良的主要原因。众所周知,长链非编码RNAs(lncRNAs)会影响基因组功能的多种组成部分,包括表观遗传学、基因转录、剪接、翻译,以及许多起支配作用的生物学过程,如细胞周期进程、细胞分化、发育和多能性。LncRNAs在各种恶性肿瘤中异常调节,并与多种RNAs和蛋白质相互作用以影响耐药性。LncRNAs通过多种分子机制调节癌症的化疗耐药,包括多药外排、抑制细胞凋亡、DNA损伤反应、表观遗传改变以及作为竞争性内源性RNA发挥作用。当与其他调节机制相结合时,这些通路形成了一个复杂的信号编排,最终导致化疗耐药。本综述就lncRNAs在诱导对用于治疗乳腺癌的常规治疗性抗癌药物产生耐药性中的作用进行了深入的探讨。作者提议,引起耐药性的lncRNAs可用于开发新的靶向和定制疗法,为引入有前景的个性化治疗方式以克服乳腺癌患者的化疗耐药性提供一种新的方法。因此,驱动抗癌药物耐药性的lncRNAs可以作为疾病预后的生物标志物进行探索,并可能提供独特的机会来规避乳腺癌患者的化疗耐药性。

Fig2. lncRNA介导的乳腺癌化疗耐药机制
原文链接:https://pubmed.ncbi.nlm.nih.gov/35810716/
A long noncoding RNA influences the choice of the X chromosome to be inactivated
长链非编码RNA影响X染色体失活的选择
发表期刊:PNAS
影响因子:12.779
发表时间:2022年7月12日
X染色体失活(XCI)是使雌性哺乳动物细胞中的一条X染色体沉默的过程,可确保两性之间的剂量补偿。尽管理论上在体细胞组织中是随机的,但选择哪一条X染色体被失活可能会因与所谓的X控制元件(Xce)相关的遗传元件而在小鼠中产生偏差。尽管Xce在近40年前首次被描述和基因定位,但其作用方式在很大程度上仍然不清楚。本研究在Xce基因座Lppnx中鉴定了一个长链非编码RNA (lncRNA),这可能是在发育的雌性小鼠胚胎中选择哪一条X染色体失活的驱动因子。通过比较弱和强Xce等位基因,研究人员发现Lppnx通过控制Xist Intron1处多能性因子的占有率来调节Xist lncRNA(XCI中的关键因子之一)的表达。在强而不是弱Xce等位基因中,这种效应被DxPas34中Rex1的增强结合所抵消,DxPas34是XCI中调节Tsix lncRNA活性的另一个关键元件,是Xist的主要拮抗剂。这些结果表明,在弱和强Xce等位基因中观察到的对XCI的不同易感性是由于Xist Intron 1和DxPas34的不同转录因子结合造成的,并且Lppnx代表了解释Xce作用的决定性因子。

Fig3. Lppnx基因座可能与小鼠ES细胞中的Xist Intron1相互作用并控制XI1中Oct4和Rex1的加载
原文链接:https://pubmed.ncbi.nlm.nih.gov/35787055/
Long noncoding RNA MAGI2-AS3 regulates the H2O2 level and cell senescence via HSPA8
长链非编码RNA MAGI2-AS3通过HSPA8调节H2O2水平和细胞衰老
发表期刊:Redox Biol
影响因子:10.787
发表时间:2022年6月30日
氧化还原稳态系统调节许多生物过程、细胞内抗氧化剂的产生和氧化还原信号。然而,长链非编码RNAs(lncRNAs)参与氧化还原调节的报道很少。本研究报道了MAGI2-AS3的下调降低了人类成纤维细胞(Fbs,一种复制性衰老模型)中的超氧化物水平。RNA pulldown结合质谱分析表明HSPA8是MAGI2-AS3的一种新型相互作用蛋白,通过PAR-CLIP进一步证实了这一结果。MAGI2-AS3的下调通过抑制HSPA8的蛋白酶体降解来稳定HSPA8蛋白水平,从而降低了过氧化氢(H2O2)的含量。进一步的证据表明,MAGI2-AS3与HSPA8的C末端结构域(CTD)相互作用。MAGI2-AS3的下调延迟了细胞衰老,而这种抗衰老作用可通过敲低HSPA8而被消除。MAGI2-AS3敲低抑制细胞衰老的潜在分子机制是通过抑制ROS/MAP2K6/p38信号通路介导的。总之,这些研究结果表明,lncRNA MAGI2-AS3的下调通过稳定HSPA8蛋白水平来降低H2O2含量并延迟了细胞衰老,从而表明了其具有潜在的抗衰老应用。

Fig4. 长链非编码RNA MAGI2-AS3的下调通过减少HSPA8的降解来减弱H2O2水平并延缓细胞衰老的示意图
原文链接:https://pubmed.ncbi.nlm.nih.gov/35797800/
A novel lncRNA RP11-386G11.10 reprograms lipid metabolism to promote hepatocellular carcinoma progression
一种新型lncRNA RP11-386G11.10重编程脂质代谢以促进肝细胞癌进展
发表期刊:Mol Metab
影响因子:8.568
发表时间:2022年7月5日
越来越多的研究表明,包括脂质代谢重编程在内的代谢变化在肝细胞癌(HCC)的进展中发挥着重要作用。但长链非编码RNAs(lncRNAs)如何影响肿瘤细胞代谢仍有待阐明。通过对TCGA-LIHC数据集的分析和筛选,本研究发现一种新的lncRNA RP11-386G11.10在HCC中过表达,并且与HCC患者的肿瘤大小、TNM分期和预后不良呈正相关。机制上,RP11-386G11.10作为miR-345-3p的竞争性内源性RNA(ceRNA)来调节HNRNPU及其下游脂肪生成酶的表达,导致HCC细胞中的脂质积累。此外,本研究将ZBTB7A鉴定为RP11-386G11.10的转录因子。此外,HNRNPU促进了HCC细胞中ZBTB7A的表达,从而提高了RP11-386G11.10的转录活性,并形成正反馈回路,最终导致脂质持续积累。本研究结果表明lncRNA RP11-386G11.10是一种新型致癌lncRNA,与HCC的不良预后密切相关。ZBTB7A-RP11-386G11.10-miR-HNRNPU正反馈环通过调节脂质合成代谢促进HCC的进展。

Fig5. HCC中RP11-386G11.10的调控机制模型
原文链接:https://pubmed.ncbi.nlm.nih.gov/35798238/