推荐产品
公司新闻/正文
Theranostics丨EVs来源的miR-144作为慢性间歇性缺氧诱导的内皮功能障碍的新机制
人阅读 发布时间:2022-06-16 09:34
阻塞性睡眠呼吸暂停(OSA)是一种非常普遍的慢性睡眠障碍,以睡眠中反复发生的部分或完全咽部塌陷为特征,伴有慢性间歇性缺氧(CIH)。OSA被鉴定为是发生全身性高血压的独立危险因素。大约50%的OSA患者有高血压,估计有70-85%的顽固性高血压患者有OSA。然而,OSA诱发高血压的确切机制尚不完全清楚。越来越多的证据表明,以内皮依赖性舒张功能受损为特征的血管内皮功能障碍,是OSA中出现临床上明显的心血管并发症之前血管损伤的最早迹象。因此,对CIH状态下内皮功能障碍的分子机制进行整体分析,将有助于全面了解OSA或CIH相关性高血压的发病机制。
氧化应激通过促进NO解偶联导致内皮功能障碍。抗氧化转录因子NRF2保留内皮功能并防止Ang II诱导的高血压。已有报道称CIH通过抑制NRF2蛋白表达诱导心肌损伤,但NRF2是否介导CIH相关的内皮功能障碍和高血压尚不清楚。
细胞外囊泡(EVs)分泌进入血液或其他体液中是发生在多细胞生物中的普遍细胞过程。EVs作为细胞间通讯的重要介质,通过将复杂分子递送给受体细胞来发挥多方面的功能,从而参与多种生理和病理过程的调节。内皮细胞是已知的吸收EVs的主要细胞类型。与内皮细胞直接和持续接触的循环EVs可以被内皮细胞吸收,从而影响血管生成、血管通透性和血管张力的调节。之前的研究表明,在糖尿病相关心肌梗死中,循环外泌体miR-144-3p抑制内皮祖细胞的迁移,进而损害新血管形成。然而,很少有研究关注循环EVs对CIH相关内皮功能障碍和高血压的作用及详细机制。
近日,Theranostics期刊在线发表了一篇题为Extracellular vesicle-derived miR-144 as a novel mechanism for chronic intermittent hypoxia-induced endothelial dysfunction的研究论文。报道了一种细胞外囊泡来源的miR-144作为慢性间歇性缺氧诱导的内皮功能障碍的新机制,暗示负载anti-miR-144的细胞外囊泡可能是治疗阻塞性睡眠呼吸暂停或慢性间歇性缺氧相关内皮功能障碍的一种有希望的方法。

首先,研究人员发现C57BL/6小鼠经过30天CIH处理后,严重减弱了其胸主动脉和颈动脉的内皮依赖性舒张(EDR),并显著升高血压 ,尤其是收缩压,但在CIH处理后重新给予正常氧气15天,这种影响被逆转。为了确定CIH诱导内皮功能障碍的机制,研究人员通过微阵列分析以鉴定C57BL/6小鼠在常氧(N)、CIH(C)和30天CIH后15天常氧(Re-Nor post-CIH)条件下主动脉中的差异表达基因。结果在CIH与常氧小鼠中鉴定了743个显著差异表达的编码基因,其中只有NRF2与血管收缩和扩张、活性氧(ROS)生成、炎症和血管生成均相关。Western-blotting结果显示,CIH暴露30天的C57BL/6小鼠的主动脉中NRF2及其下游靶标 CATALASE(CAT)的水平显著降低,并且在Re-Nor post-CIH组中恢复。此外,研究发现CIH处理的小鼠主动脉内皮细胞中超氧化物的产生明显增加。

为了探索CIH S-EVs对EDRs的影响,研究人员评估了S-EVs的特征。结果显示,从正常C57BL/6小鼠中分离出的大多数S-EVs呈现出直径约100nm的典型圆盘状囊泡。EV标志物,尤其是外泌体相关蛋白CD9、CD63、CD81、ALIX和TSG101在EV组分中富集。纳米粒子追踪分析显示,300μL血清产生的S-EVs的平均尺寸为111.0±57.2 nm,而CIH S-EVs的数量约为常氧组(Nor S-EVs)的2倍。En face染色表明PKH67标记的C57BL/6小鼠S-EV以时间依赖性方式被内皮细胞吸收。

接着,研究人员发现直接暴露于CIH S-EVs 48h可减弱C57BL/6小鼠胸主动脉中的EDR,并减少C57BL/6小鼠肠系膜动脉中的血流介导性扩张。联合肝素(EV吸收阻断剂)处理可逆转CIH s -EV对小鼠主动脉EDR的损害。为了进一步确定CIH S-EVs如何对EDR产生不利影响,研究人员通过转录组微阵列分析来鉴定CIH S-EVs或Nor S-EVs处理的HUVECs中的差异表达基因。结果鉴定出19个显著差异表达的编码基因,其中,Nrf2是CIH S-EV处理的HUVEC和CIH处理的小鼠主动脉仅有的共有的差异表达基因。进一步的验证表明,CIH S-EV离体处理确实降低了NRF2及其靶点CAT在小鼠内皮细胞系H5V和小鼠主动脉中的蛋白表达。此外,CIH S-EV处理48h可增加H5V细胞和主动脉内皮细胞中超氧阴离子的产生。表明NRF2降低可能是导致CIH S-EV诱导的内皮细胞超氧阴离子过度产生的主要分子。

为了确定CIH S-EVs降低NRF2和受损内皮功能的机制,研究人员通过qPCR检测了常氧和CIH处理的小鼠S-EVs中与氧化应激或缺氧信号相关的几个EV相关miRNAs。结果显示,CIH S-EVs中miR-126的水平降低,而miR-132、miR-150、miR-27a和miR-144的水平升高。之前的研究表明在Nrf2的3'-UTR中存在miR-27a和miR-144a的保守结合序列,使用agomiR-144和agomiR-27a过表达miR-144和miR-27a会降低H5V中NRF2及其靶标CAT的蛋白质水平,并抑制293A细胞中Nrf2-3'UTR驱动的荧光素酶活性。
此外,qPCR结果显示,在间歇性缺氧(IH)处理24h后,成熟的miR-27a及其初级转录本pri-miR-27a(但不是miR-144或pri-miR-144)在H5V中被诱导,表明除miR-144外,miR-27a在内皮细胞中内源性表达,并对IH刺激有反应。在H5V细胞中几乎检测不到miR-144的表达,但CIH S-EV处理显著增加了H5V细胞中miR-144的丰度。而无论是否用actinomycin D抑制内源性miRNA的产生,这种效应都持续存在,表明内皮miR-144信号主要来自S-EVs。 因此,选择EV miR-144作为进一步研究的目标分子。

由于miR-144主要在红细胞中表达并参与红系分化。为了阐明miR-144在CIH S-EV中的细胞来源,研究人员通过超离心从C57BL/6小鼠红细胞中分离出红细胞来源的细胞外囊泡(E-EVs),并对其进行表征。结果显示E-EVs呈现典型的圆盘形状,平均直径为115.0±50.9nm。此外,在E-EV组分中还观察到红细胞蛋白HBA。qPCR分析显示miR-144在CIH处理的C57BL/6小鼠红细胞和OSA患者红细胞的E-EVs中显著上调。
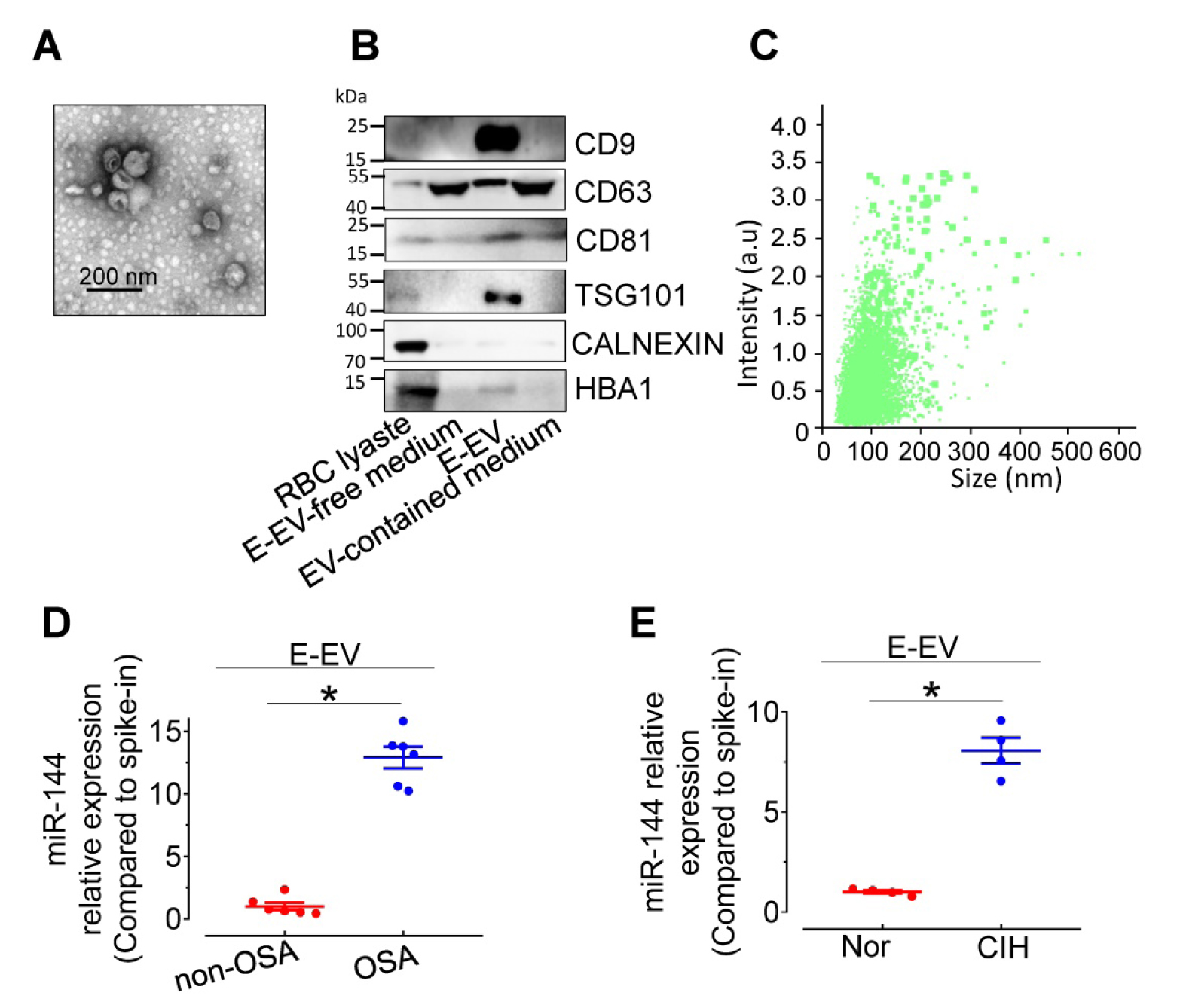
Fig5. E-EVs的表征和E-EVs中miR-144的表达
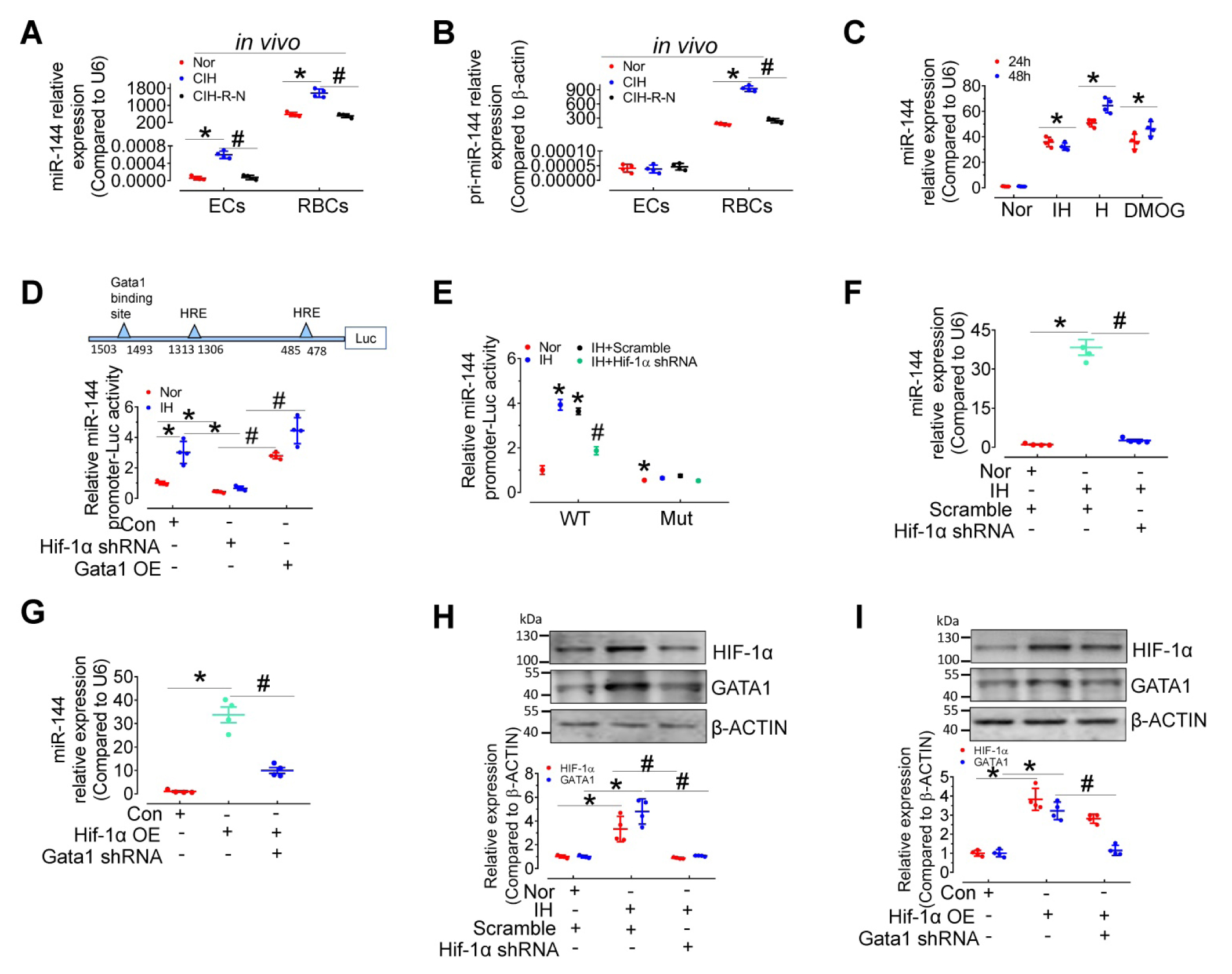
为了进一步证明EV介导的红细胞和内皮细胞之间的细胞间通讯,研究人员检测了常氧、30天CIH或30天CIH后15天常氧条件(CIH-R-N)处理后C57BL/6小鼠红细胞和内皮细胞中pri和成熟miR-144的水平。qPCR结果表明miR-144和pri-miR-144的表达在红细胞中占优势,而不是在内皮细胞中。CIH状态下,pri-miR-144和miR-144在红细胞中的表达显著升高,恢复常氧15天后趋势逆转;而在主动脉内皮细胞中,只有miR-144被上调,表明内皮细胞中的miR-144极有可能从体内红细胞外源性转移。接下来,研究人员通过一系列实验探索了缺氧状态下红细胞中miR-144的分子调控作用。结果表明,缺氧时miR-144可直接受HIF-1α调控或受HIF-1α/GATA1通路间接调控。
最后,为了进一步验证CIH E-EVs递送miR-144对内皮细胞的影响,研究人员使用anti-miR-144 和负载anti-miR-144的CIH E-EVs在体外治疗主动脉或在体内治疗CIH小鼠。结果显示,负载anti-miR-144的CIH E-EV在孵育48h后并未增加H5V细胞中的miR-144水平,且H5V细胞中NRF2和CAT的蛋白质水平保持在对照组中观察到的水平。一致地,通过尾静脉注射进行的体内CIH E-EV治疗可增强内皮细胞中超氧阴离子的产生。然而,这种作用在负载anti-miR-144的CIH E-EV治疗组中在很大程度上被抑制。同时,CIH E-EVs的体内治疗会损害常氧和CIH治疗小鼠的EDR并增加收缩压。这些影响在用anti-miR-144负载的CIH E-EVs治疗组中降低。同样,antagomiR-144显著逆转了由CIH小鼠或OSA患者E-EV引起的内皮功能障碍。

总之,本研究系统地证明了CIH S-EV和CIH E-EV可以将功能性miR-144传递给内皮细胞,通过降低NRF2表达来促进超氧阴离子的产生。该研究结果为负载anti-miR-144的EV或antagomir-144在治疗OSA或CIH相关血管并发症中的治疗潜力提供了实验证据。
原文链接:https://www.thno.org/v12p4237.htm
本研究使用到的miRNA agomir、antagomir产品均由锐博生物提供!更多外泌体miRNA研究产品与服务信息,欢迎登陆锐博生物官网(www.ribobio.com)进行查询或来电咨询!
氧化应激通过促进NO解偶联导致内皮功能障碍。抗氧化转录因子NRF2保留内皮功能并防止Ang II诱导的高血压。已有报道称CIH通过抑制NRF2蛋白表达诱导心肌损伤,但NRF2是否介导CIH相关的内皮功能障碍和高血压尚不清楚。
细胞外囊泡(EVs)分泌进入血液或其他体液中是发生在多细胞生物中的普遍细胞过程。EVs作为细胞间通讯的重要介质,通过将复杂分子递送给受体细胞来发挥多方面的功能,从而参与多种生理和病理过程的调节。内皮细胞是已知的吸收EVs的主要细胞类型。与内皮细胞直接和持续接触的循环EVs可以被内皮细胞吸收,从而影响血管生成、血管通透性和血管张力的调节。之前的研究表明,在糖尿病相关心肌梗死中,循环外泌体miR-144-3p抑制内皮祖细胞的迁移,进而损害新血管形成。然而,很少有研究关注循环EVs对CIH相关内皮功能障碍和高血压的作用及详细机制。
近日,Theranostics期刊在线发表了一篇题为Extracellular vesicle-derived miR-144 as a novel mechanism for chronic intermittent hypoxia-induced endothelial dysfunction的研究论文。报道了一种细胞外囊泡来源的miR-144作为慢性间歇性缺氧诱导的内皮功能障碍的新机制,暗示负载anti-miR-144的细胞外囊泡可能是治疗阻塞性睡眠呼吸暂停或慢性间歇性缺氧相关内皮功能障碍的一种有希望的方法。

首先,研究人员发现C57BL/6小鼠经过30天CIH处理后,严重减弱了其胸主动脉和颈动脉的内皮依赖性舒张(EDR),并显著升高血压 ,尤其是收缩压,但在CIH处理后重新给予正常氧气15天,这种影响被逆转。为了确定CIH诱导内皮功能障碍的机制,研究人员通过微阵列分析以鉴定C57BL/6小鼠在常氧(N)、CIH(C)和30天CIH后15天常氧(Re-Nor post-CIH)条件下主动脉中的差异表达基因。结果在CIH与常氧小鼠中鉴定了743个显著差异表达的编码基因,其中只有NRF2与血管收缩和扩张、活性氧(ROS)生成、炎症和血管生成均相关。Western-blotting结果显示,CIH暴露30天的C57BL/6小鼠的主动脉中NRF2及其下游靶标 CATALASE(CAT)的水平显著降低,并且在Re-Nor post-CIH组中恢复。此外,研究发现CIH处理的小鼠主动脉内皮细胞中超氧化物的产生明显增加。

Fig1. CIH处理会损害EDR、降低NRF2表达并促进超氧阴离子的产生
为了探索CIH S-EVs对EDRs的影响,研究人员评估了S-EVs的特征。结果显示,从正常C57BL/6小鼠中分离出的大多数S-EVs呈现出直径约100nm的典型圆盘状囊泡。EV标志物,尤其是外泌体相关蛋白CD9、CD63、CD81、ALIX和TSG101在EV组分中富集。纳米粒子追踪分析显示,300μL血清产生的S-EVs的平均尺寸为111.0±57.2 nm,而CIH S-EVs的数量约为常氧组(Nor S-EVs)的2倍。En face染色表明PKH67标记的C57BL/6小鼠S-EV以时间依赖性方式被内皮细胞吸收。

Fig2. 从C57BL/6小鼠血清中分离的细胞外囊泡可被主动脉内皮细胞吸收
接着,研究人员发现直接暴露于CIH S-EVs 48h可减弱C57BL/6小鼠胸主动脉中的EDR,并减少C57BL/6小鼠肠系膜动脉中的血流介导性扩张。联合肝素(EV吸收阻断剂)处理可逆转CIH s -EV对小鼠主动脉EDR的损害。为了进一步确定CIH S-EVs如何对EDR产生不利影响,研究人员通过转录组微阵列分析来鉴定CIH S-EVs或Nor S-EVs处理的HUVECs中的差异表达基因。结果鉴定出19个显著差异表达的编码基因,其中,Nrf2是CIH S-EV处理的HUVEC和CIH处理的小鼠主动脉仅有的共有的差异表达基因。进一步的验证表明,CIH S-EV离体处理确实降低了NRF2及其靶点CAT在小鼠内皮细胞系H5V和小鼠主动脉中的蛋白表达。此外,CIH S-EV处理48h可增加H5V细胞和主动脉内皮细胞中超氧阴离子的产生。表明NRF2降低可能是导致CIH S-EV诱导的内皮细胞超氧阴离子过度产生的主要分子。

Fig3. CIH S-EVs损害内皮功能,增加超氧阴离子的产生,并降低内皮细胞中NRF2的表达
为了确定CIH S-EVs降低NRF2和受损内皮功能的机制,研究人员通过qPCR检测了常氧和CIH处理的小鼠S-EVs中与氧化应激或缺氧信号相关的几个EV相关miRNAs。结果显示,CIH S-EVs中miR-126的水平降低,而miR-132、miR-150、miR-27a和miR-144的水平升高。之前的研究表明在Nrf2的3'-UTR中存在miR-27a和miR-144a的保守结合序列,使用agomiR-144和agomiR-27a过表达miR-144和miR-27a会降低H5V中NRF2及其靶标CAT的蛋白质水平,并抑制293A细胞中Nrf2-3'UTR驱动的荧光素酶活性。
此外,qPCR结果显示,在间歇性缺氧(IH)处理24h后,成熟的miR-27a及其初级转录本pri-miR-27a(但不是miR-144或pri-miR-144)在H5V中被诱导,表明除miR-144外,miR-27a在内皮细胞中内源性表达,并对IH刺激有反应。在H5V细胞中几乎检测不到miR-144的表达,但CIH S-EV处理显著增加了H5V细胞中miR-144的丰度。而无论是否用actinomycin D抑制内源性miRNA的产生,这种效应都持续存在,表明内皮miR-144信号主要来自S-EVs。 因此,选择EV miR-144作为进一步研究的目标分子。

Fig4. miR-144在CIH S-EVs中增加,并通过S-EVs递送至内皮细胞
由于miR-144主要在红细胞中表达并参与红系分化。为了阐明miR-144在CIH S-EV中的细胞来源,研究人员通过超离心从C57BL/6小鼠红细胞中分离出红细胞来源的细胞外囊泡(E-EVs),并对其进行表征。结果显示E-EVs呈现典型的圆盘形状,平均直径为115.0±50.9nm。此外,在E-EV组分中还观察到红细胞蛋白HBA。qPCR分析显示miR-144在CIH处理的C57BL/6小鼠红细胞和OSA患者红细胞的E-EVs中显著上调。

Fig5. E-EVs的表征和E-EVs中miR-144的表达
为了进一步证明EV介导的红细胞和内皮细胞之间的细胞间通讯,研究人员检测了常氧、30天CIH或30天CIH后15天常氧条件(CIH-R-N)处理后C57BL/6小鼠红细胞和内皮细胞中pri和成熟miR-144的水平。qPCR结果表明miR-144和pri-miR-144的表达在红细胞中占优势,而不是在内皮细胞中。CIH状态下,pri-miR-144和miR-144在红细胞中的表达显著升高,恢复常氧15天后趋势逆转;而在主动脉内皮细胞中,只有miR-144被上调,表明内皮细胞中的miR-144极有可能从体内红细胞外源性转移。接下来,研究人员通过一系列实验探索了缺氧状态下红细胞中miR-144的分子调控作用。结果表明,缺氧时miR-144可直接受HIF-1α调控或受HIF-1α/GATA1通路间接调控。

Fig6. 间歇性缺氧时红细胞中miR-144的表达与调控
最后,为了进一步验证CIH E-EVs递送miR-144对内皮细胞的影响,研究人员使用anti-miR-144 和负载anti-miR-144的CIH E-EVs在体外治疗主动脉或在体内治疗CIH小鼠。结果显示,负载anti-miR-144的CIH E-EV在孵育48h后并未增加H5V细胞中的miR-144水平,且H5V细胞中NRF2和CAT的蛋白质水平保持在对照组中观察到的水平。一致地,通过尾静脉注射进行的体内CIH E-EV治疗可增强内皮细胞中超氧阴离子的产生。然而,这种作用在负载anti-miR-144的CIH E-EV治疗组中在很大程度上被抑制。同时,CIH E-EVs的体内治疗会损害常氧和CIH治疗小鼠的EDR并增加收缩压。这些影响在用anti-miR-144负载的CIH E-EVs治疗组中降低。同样,antagomiR-144显著逆转了由CIH小鼠或OSA患者E-EV引起的内皮功能障碍。

Fig7. Anti-miR-144可逆转CIH E-EV诱导的超氧阴离子过度产生、NRF2减少和内皮功能障碍
总之,本研究系统地证明了CIH S-EV和CIH E-EV可以将功能性miR-144传递给内皮细胞,通过降低NRF2表达来促进超氧阴离子的产生。该研究结果为负载anti-miR-144的EV或antagomir-144在治疗OSA或CIH相关血管并发症中的治疗潜力提供了实验证据。
原文链接:https://www.thno.org/v12p4237.htm
本研究使用到的miRNA agomir、antagomir产品均由锐博生物提供!更多外泌体miRNA研究产品与服务信息,欢迎登陆锐博生物官网(www.ribobio.com)进行查询或来电咨询!