广州市锐博生物科技有限公司品牌商
18 年
手机商铺
- NaN
- 0
- 0
- 1
- 0
推荐产品
公司新闻/正文
【锐见风向】新分子EP300作用不小,能调控SOCS1表达促进肿瘤免疫逃逸…
14 人阅读发布时间:2026-01-26 16:52
免疫调控领域热度不减,长居国自然中标榜首。这些高分文献究竟是如何实现的?本期【锐见风向】继续带您追踪免疫领域的高分文章,拆解研究背后的“秘密武器”和硬核技术。
背景回顾
免疫调节是机体通过免疫系统识别和排除抗原性异物以维持生理平衡的生理功能,通过免疫细胞、分子及神经内分泌系统的相互作用实现,涉及神经递质、内分泌激素与免疫细胞的受体介导机制。其机制控制免疫应答的强度与持续时间,可分为自身调节、整体调节和群体调节三个层次,调节异常可引发自身免疫病、过敏反应,双向调节表现为抗原入侵时增强应答,清除后自限终止。
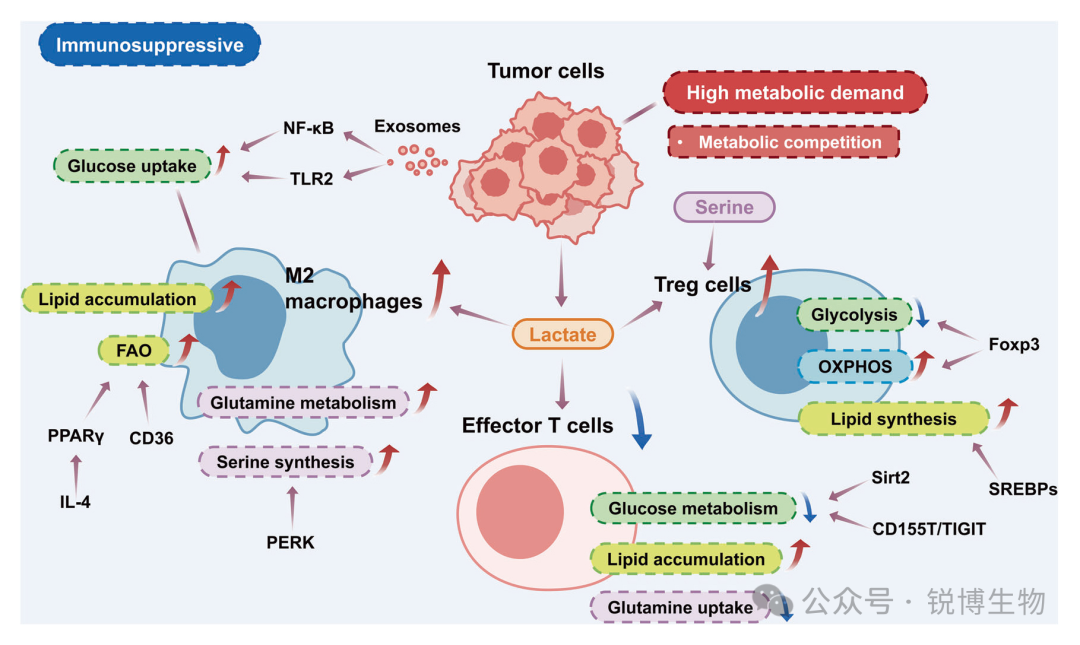
Hu, Tengyue et al, Signal Transduction and Targeted Therapy ,2024.
EP300 compromises antitumor immunity by increasing SOCS1 expression
发表期刊及影响因子: Journal for immunotherapy of cancer(if=10.6)
核心摘要
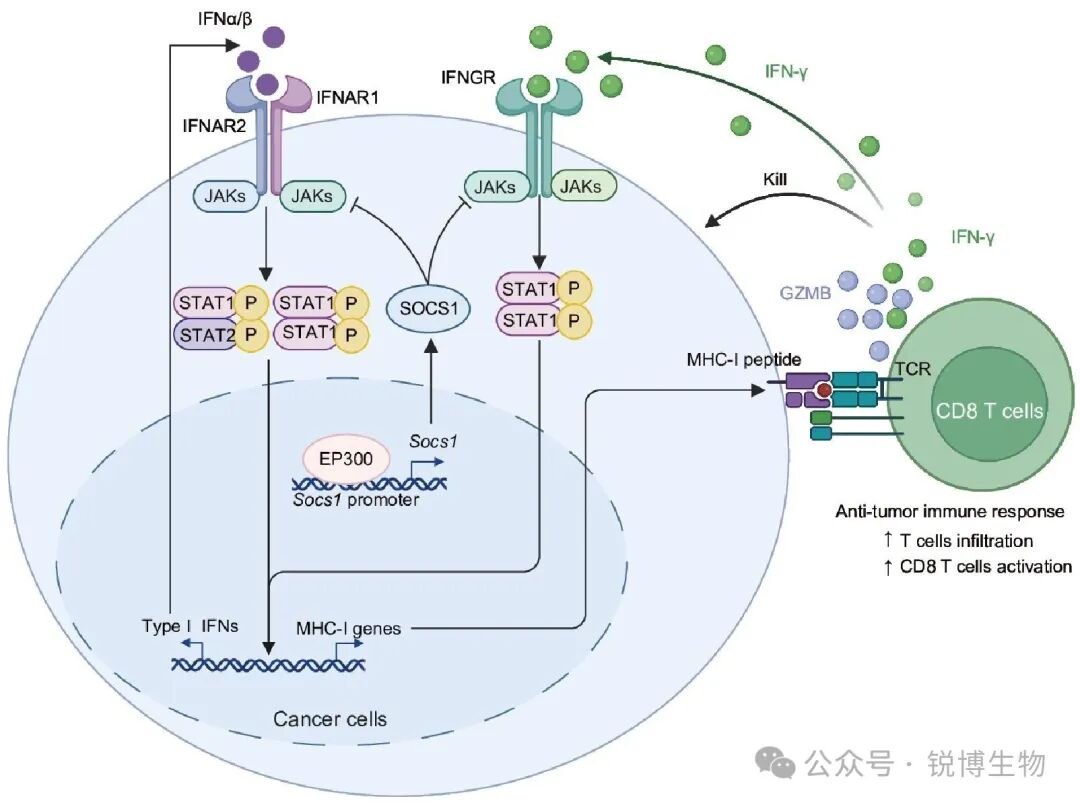
除了支持癌细胞增殖外,肿瘤生长还依赖于癌细胞逃避免疫监视的能力。识别促进肿瘤免疫逃逸的新分子可能有助于开发更有效的免疫治疗策略。EP300通过SOCS1上调抑制抗原呈递基因表达,从而促进肿瘤免疫逃逸。研究结果揭示EP300上调细胞因子信号传导1(SOCS1)表达抑制因子,从而抑制信号转导和转录激活因子1的磷酸化。这导致抗原呈递基因下调,使癌细胞能够逃避CD8 T细胞的免疫监视。

研究思路图解
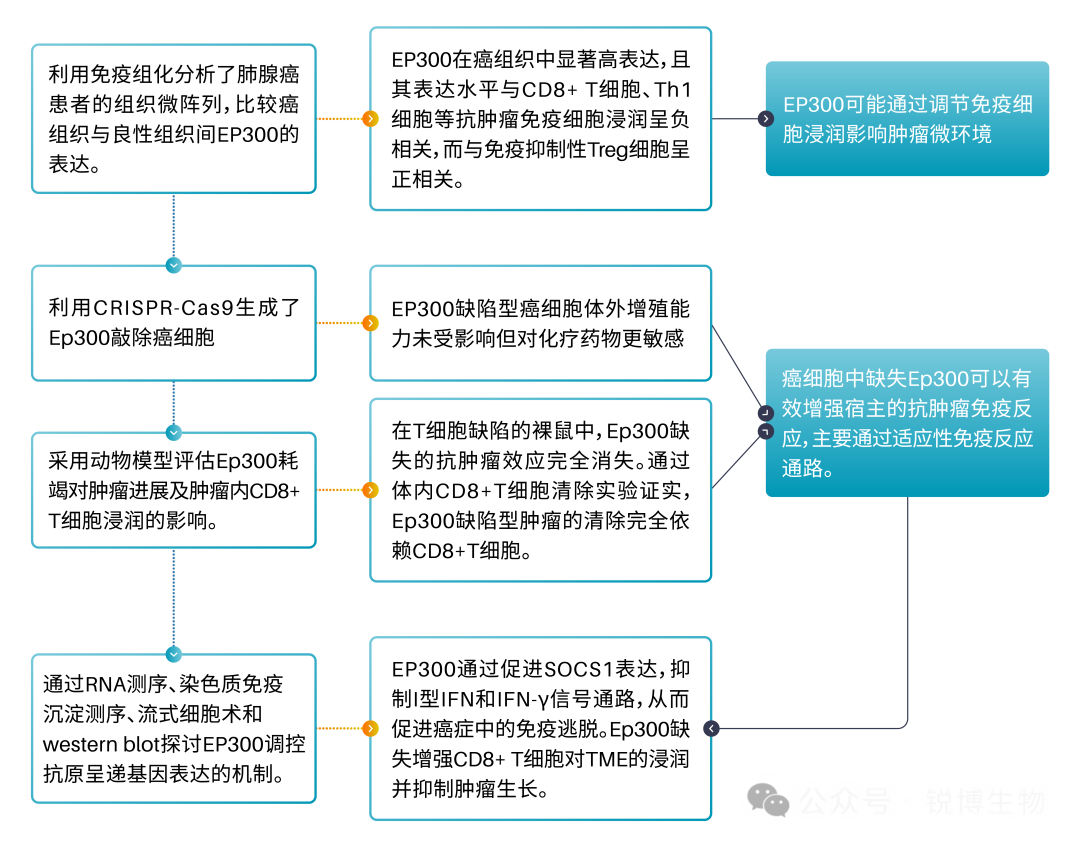
研究思路与结果
► 首先,从临床样本出发,研究人员利用免疫组化分析发现EP300在肺腺癌等肿瘤组织中高表达,且其表达与CD8⁺ T细胞浸润呈负相关。这提示EP300可能与免疫逃逸有关。
► 接下来,为了验证EP300的功能,利用CRISPR-Cas9技术敲除肿瘤细胞中的Ep300基因,并将肿瘤细胞移植到小鼠体内。结果发现,在免疫系统正常的小鼠中,缺失EP300的肿瘤生长被显著抑制;但在缺乏T细胞的免疫缺陷小鼠中,却并没有抑制效果。这表明EP300的缺失触发了依赖适应性免疫系统的抗肿瘤反应。
► 然后,随着深入地探究了发生的分子机制,研究人员发现,EP300缺失的肿瘤细胞的I型干扰素信号通路因此被激活,导致下游STAT1磷酸化增强。关键的是,这进一步上调了主要组织相容性复合体I类(MHC-I)抗原呈递相关基因的表达,使得肿瘤细胞更容易被CD8⁺ T细胞识别和杀伤。
► 最后,对机制的进一步研究表明了EP300作为转录共激活因子,能够直接结合并促进Socs1基因的转录。而SOCS1蛋白会抑制STAT1的磷酸化。因此,EP300通过上调SOCS1,间接抑制了STAT1激活和MHC-I的表达,从而帮助肿瘤细胞实现免疫逃逸。为了验证EP300在临床上的治疗潜力,使用靶向EP300的降解剂(JQAD1)或特异性siRNA进行治疗,在体内均能有效抑制肿瘤生长。
概括而言,此项研究勾勒出了一条清晰EP300的信号通路:
EP300 → SOCS1 ↑ → STAT1磷酸化 ↓ → MHC-I ↓ → CD8⁺ T细胞杀伤 ↓ → 肿瘤免疫逃逸
为EP300作为肿瘤免疫治疗的新靶点提供了理论基础。
RiboBio
锐博助力
In vivo siEp300 or in vivo siNC, which chemically modified with 5Col/2OMe was synthesized by RiboBio (Guangzhou, China).
原文链接:
参考文献
[1] Hu, Tengyue et al. “Metabolic regulation of the immune system in health and diseases: mechanisms and interventions.” Signal transduction and targeted therapy vol. 9,1 268. 9 Oct. 2024, doi:10.1038/s41392-024-01954-6
[2] Zeng, Yanqiong et al. “EP300 compromises antitumor immunity by increasing SOCS1 expression.” Journal for immunotherapy of cancer vol. 13,10 e011488. 15 Oct. 2025, doi:10.1136/jitc-2025-011488