广州市锐博生物科技有限公司品牌商
18 年
手机商铺
- NaN
- 0
- 0
- 1
- 0
推荐产品
公司新闻/正文
lncRNA研究进展盘点丨20240112期
360 人阅读发布时间:2024-01-12 08:55
01
XIST directly regulates X-linked and autosomal genes in naive human pluripotent cells
XIST直接调控原始人类多能细胞中的X连锁和常染色体基因
发表期刊:Cell
影响因子:64.5
发表时间:2024年1月4日
X染色体失活(XCI)是RNA介导的基因表达调控的范例,其中长链非编码RNA XIST以顺式方式分布在X染色体上,介导全染色体的基因沉默。在女性原始人类多能干细胞(hPSC)中,XIST呈分散构型,而XCI不发生,这引发了对XIST's功能的质疑。本研究发现XIST在X染色体上扩散,并诱导原始hPSCs中X连锁基因表达的抑制。令人惊讶的是,XIST还靶向特定的常染色体区域,在那里它诱导抑制性染色质变化和基因表达抑制。因此,XIST在诱导常染色体差异的同时,使雄性和雌性细胞之间的X连锁基因剂量相等。分散的Xist构型和常染色体定位在小鼠PSCs的XCI起始过程中也短暂发生。总之,本研究确定了XIST是X染色体抑制的调节因子,揭示了XIST/Xist在进化上保守的反式作用,并揭示了XIST/Xist扩散与常染色体靶向之间的相关性。
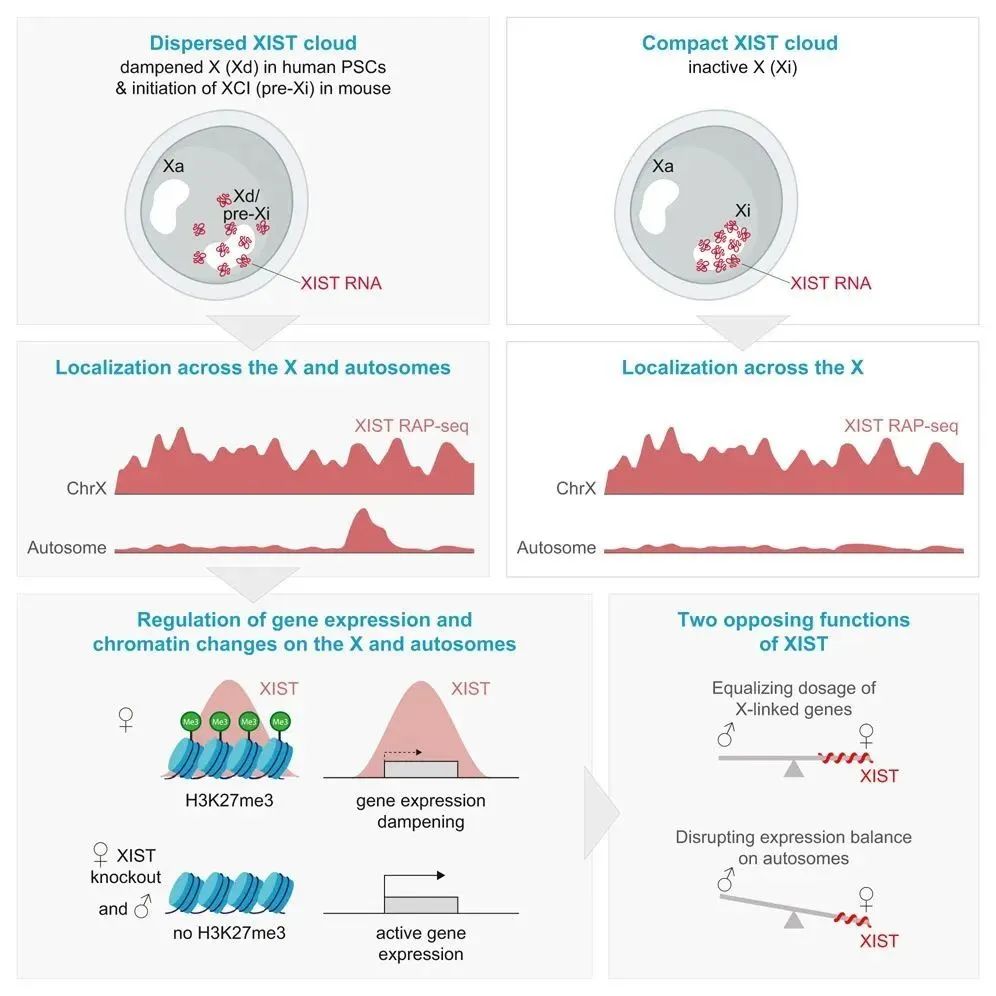
Fig1. 研究模型示意图
原文链接:
https://pubmed.ncbi.nlm.nih.gov/38181737/
02
Computational prediction and experimental validation identify functionally conserved lncRNAs from zebrafish to human
计算预测和实验验证鉴定了从斑马鱼到人类的功能保守的lncRNAs
发表期刊:Nat Genetics
影响因子:30.8
发表时间:2024年1月9日
长链非编码RNAs(lncRNAs)的功能研究因缺乏评估其进化的方法而受到阻碍。本研究提出了lncRNA Homology Explorer(lncHOME),这是一种计算管道,可识别一类独特的长链非编码RNAs(lncRNAs),它们具有保守的基因组位置和RNA结合蛋白(RBP)结合位点(coPARSE-lncRNAs)的模式。值得注意的是,数百个人类coPARSE-lncRNAs在进化上可以追溯到斑马鱼。使用CRISPR-Cas12a敲除和挽救试验,本研究发现敲除许多人类coPARSE-lncRNAs会导致细胞增殖缺陷,这些缺陷随后被预测的斑马鱼同源物挽救。敲低斑马鱼胚胎中的coPARSE-lncRNAs会导致严重的发育迟缓,而人类同源物则挽救了这些迟缓。此外,本研究验证了人类、小鼠和斑马鱼的coPARSE-lncRNA同源物倾向于结合相似的RBPs,其保守功能依赖于特定的RBP结合位点。总体而言,本研究展示了一种研究lncRNA功能保守的综合方法,并涉及许多lncRNAs在调节脊椎动物生理学中的作用。
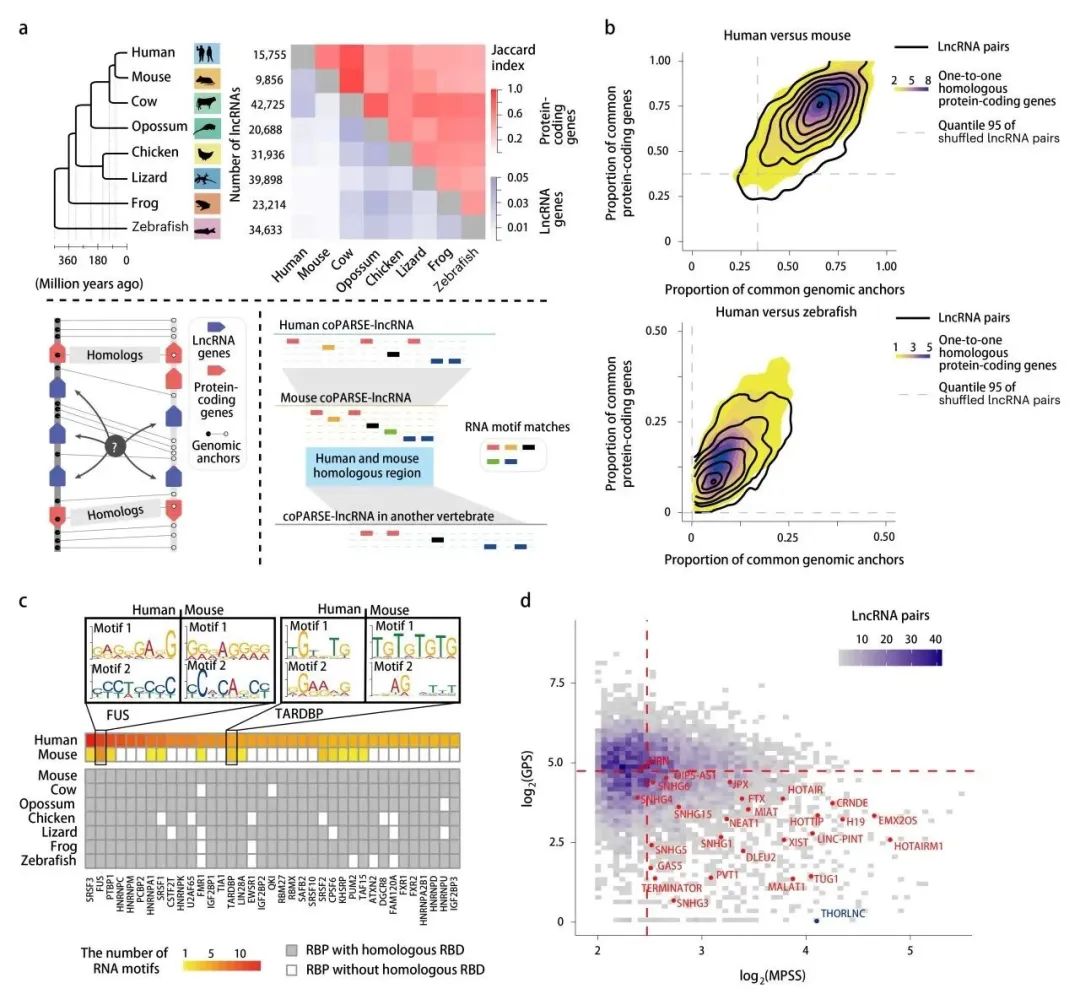
Fig2. 跨脊椎动物的coPARSE-lncRNA及其同源物的鉴定
原文链接:
https://pubmed.ncbi.nlm.nih.gov/38195860/
03
LncRNA Malat1 suppresses pyroptosis and T cell-mediated killing of incipient metastatic cells
LncRNA Malat1抑制细胞焦亡和T细胞介导的早期转移细胞杀伤
发表期刊:Nat Cancer
影响因子:22.7
发表时间:2024年1月9日
抗肿瘤免疫对转移性休眠的作用知之甚少。本研究表明,在乳腺癌和其他肿瘤类型的小鼠模型中,长链非编码RNA Malat1是肿瘤起始和转移再激活所必需的。Malat1定位于核斑点以偶联转录、剪接和mRNA成熟。在转移细胞中,Malat1诱导WNT配体、自分泌环以促进自我更新和丝氨酸蛋白酶抑制剂的表达。通过抑制caspase-1和组织蛋白酶G,SERPINB6B阻止gasdermin D介导的焦亡诱导。通过这种方式,SERPINB6B抑制免疫原性细胞死亡,并赋予早期转移细胞逃避T细胞介导的肿瘤消除。使用治疗性反义核苷酸对Malat1进行靶向抑制能够以SERPINB6B依赖性方式抑制转移。这些结果表明,Malat1诱导的SERPINB6B表达可以滴定转移部位的焦亡和免疫识别。因此,Malat1处于肿瘤起始、再激活和免疫逃逸的纽带,是一种易于处理且临床相关的药物靶点。
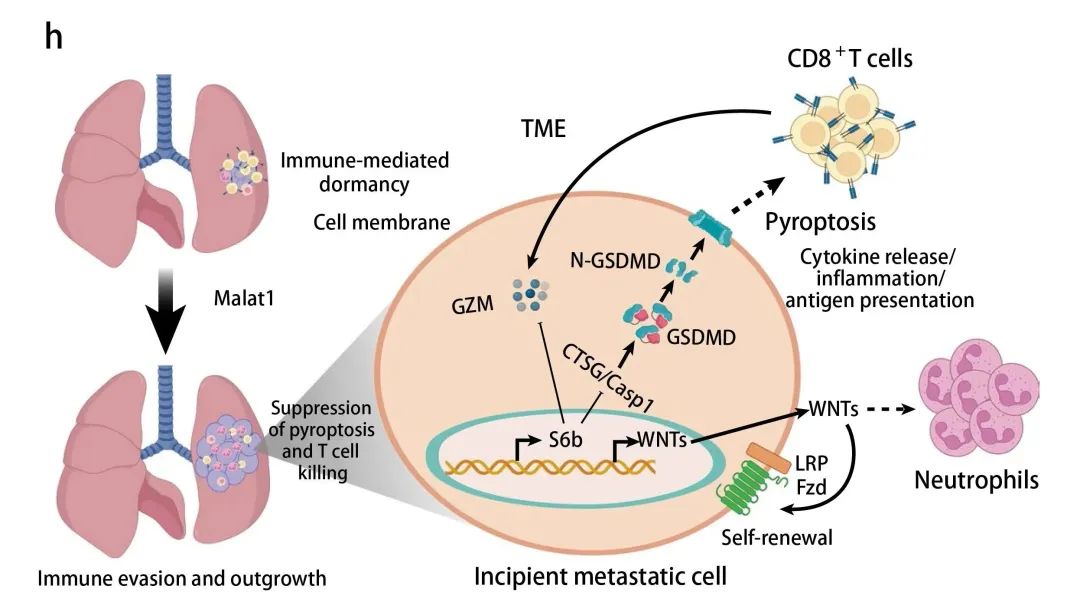
Fig3. MALAT1在早期转移部位促进T细胞介导的抗肿瘤免疫逃避机制模型图
原文链接:
https://pubmed.ncbi.nlm.nih.gov/38195932/
04
Allele-specific control of rodent and human lncRNA KMT2E-AS1 promotes hypoxic endothelial pathology in pulmonary hypertension
啮齿动物和人类lncRNA KMT2E-AS1的等位基因特异性控制促进肺动脉高压的缺氧内皮病理学
发表期刊:Sci Transl Med
影响因子:17.1
发表时间:2024年1月10日
脉管系统的缺氧重编程依赖于遗传、表观遗传和代谢回路,但控制点尚不清楚。在肺动脉高压(PAH,一种由缺氧诱导因子(HIF)依赖性血管功能障碍驱动的疾病)中,HIF-2α促进邻近基因、长链非编码RNA(lncRNA)组蛋白赖氨酸N-甲基转移酶2E-反义1(KMT2E-AS1)和组蛋白赖氨酸N-甲基转移酶2E(KMT2E)的表达。KMT2E-AS1稳定KMT2E蛋白以增加表观遗传组蛋白3赖氨酸4三甲基化(H3K4me3),驱动HIF-2α依赖性代谢和致病性内皮活性。该lncRNA轴还增加了表观遗传、转录和转录后背景中的HIF-2α表达,从而促进了一个正反馈回路,以进一步增强HIF-2α的活性。本研究在KMT2E内含子中的单核苷酸变异(SNV)rs73184087与PAH发现和重复患者队列以及全球Meta分析中的疾病风险之间存在遗传关联。该SNV与HIF-2α表现出等位基因(G)特异性关联,参与远程染色质相互作用,并在缺氧(G/G)细胞中诱导lncRNA-KMT2E串联。在体内,KMT2E-AS1缺失可以保护小鼠免受PAH的影响,正如在大鼠中药物抑制组蛋白甲基化一样。相反,强制lncRNA表达会导致更严重的PH。因此,KMT2E-AS1/KMT2E协调跨聚合多组学景观以介导HIF-2α病理生物学,并代表了肺动脉高压的关键临床靶点。
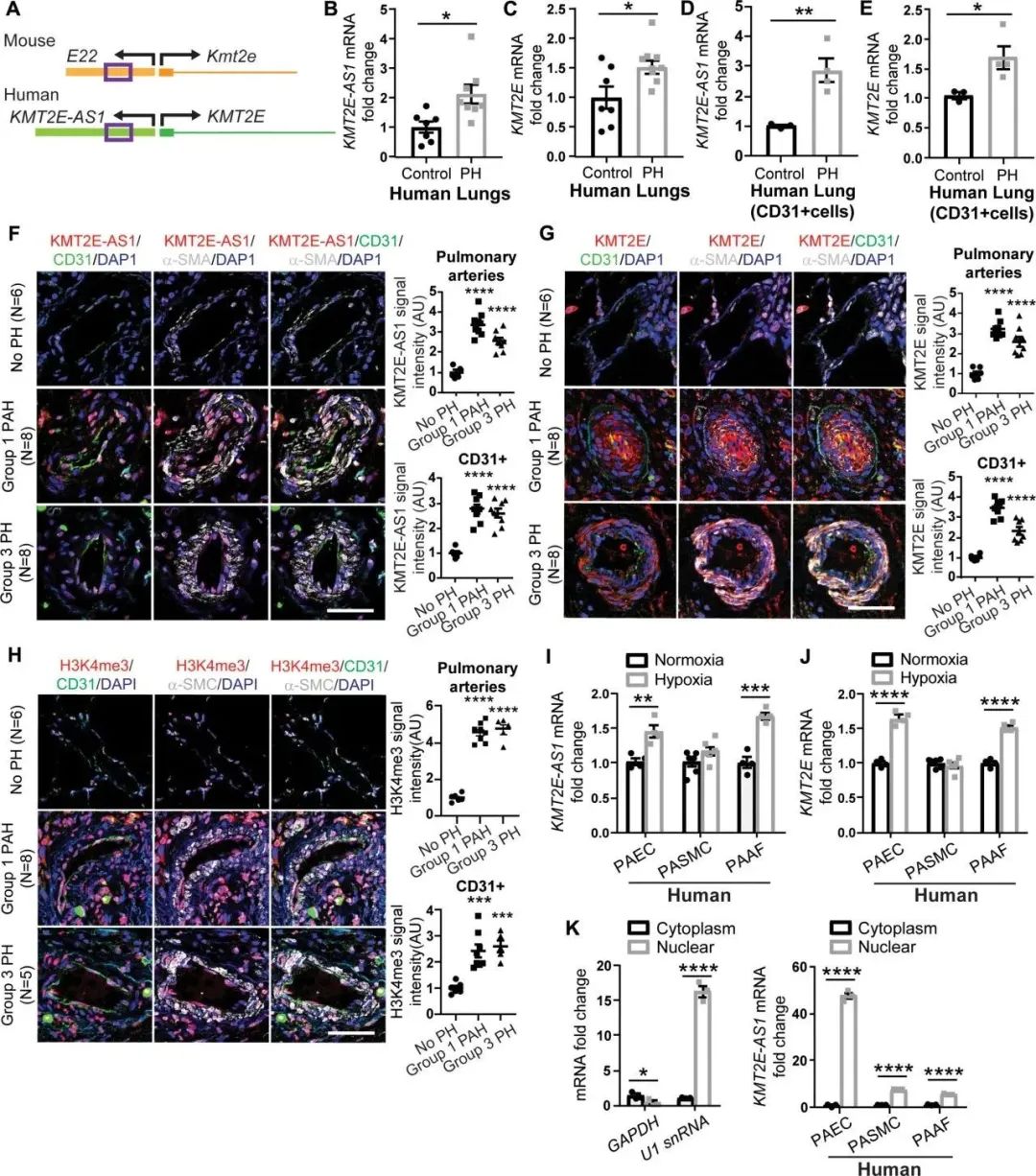
Fig4. 人类KMT2E-AS1和邻近的KMT2E在体内和体外PH模型中上调
原文链接:
https://pubmed.ncbi.nlm.nih.gov/38198571/
05
METTL3 drives telomere targeting of TERRA lncRNA through m6A-dependent R-loop formation: a therapeutic target for ALT-positive neuroblastoma
METTL3通过m6A依赖性R-loop形成驱动TERRA lncRNA的端粒靶向:ALT阳性神经母细胞瘤的治疗靶点
发表期刊:Nucleic Acids Res
影响因子:14.9
发表时间:2024年1月5日
端粒酶阴性肿瘤通过端粒选择性延长(ALT)来维持端粒长度,但ALT背后的潜在机制仍知之甚少。部分侵袭性神经母细胞瘤(NB),尤其是复发性肿瘤,ALT呈阳性(ALT+),这表明更好地剖析ALT机制可能会带来新的治疗机会。TERRA是一种源自端粒末端的长链非编码RNA(lncRNA),以R-loop依赖性方式定位于端粒,在端粒维持中起着至关重要的作用。本研究提出了证据表明甲基转移酶METTL3在TERRA中内部腺苷(m6A)的N6位置的RNA修饰对于ALT+细胞的端粒维持至关重要,并且TERRA m6A/METTL3的丢失导致端粒损伤。研究人员观察到m6A修饰在R-loop富集的TERRA中大量存在,并且m6A介导的hnRNPA2B1向TERRA的募集对R-loop的形成至关重要。本研究结果表明,m6A通过R-loop驱动TERRA的端粒靶向,并且这种m6A介导的R-loop形成可能是其他染色质相互作用lncRNA广泛采用的机制。此外,采用METTL3抑制剂治疗ALT+ NB细胞导致TERRA端粒靶向受损和端粒DNA损伤的积累,表明METTL3抑制可能代表ALT+ NB的治疗方法。
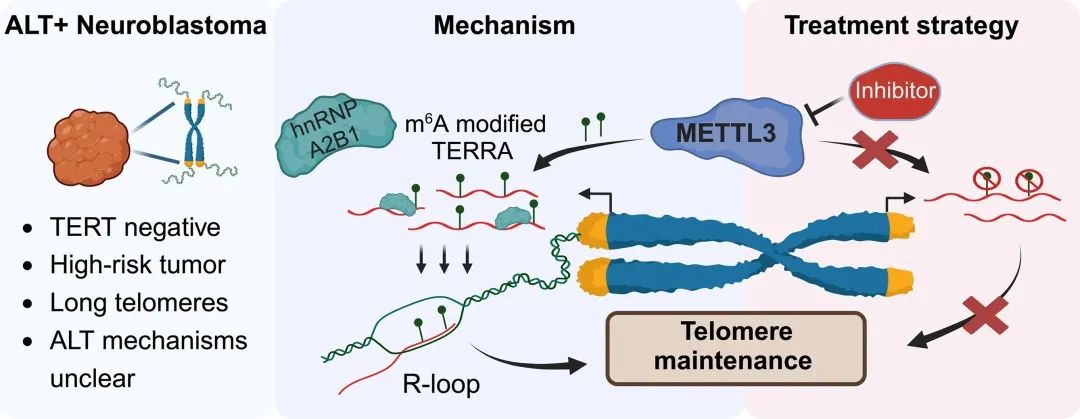
Fig5. 研究模型示意图
原文链接:
https://pubmed.ncbi.nlm.nih.gov/38180812/