推荐产品
公司新闻/正文
动物用siRNA应用案例丨含动物造模、实验处理、给药方式、给药剂量……
人阅读 发布时间:2024-03-19 15:50
In vivo siRNA最关键的问题就是siRNA稳定性及给药策略,适当的化学修饰是解决siRNA稳定的重要方法之一。锐博生物研发的genOFFTM in vivo siRNA,采用特殊的化学修饰方式,大大提高了siRNA的血清稳定性,并保持了siRNA的高效活性;通过采用国际先进的处理方法,能够最大限度降低对实验动物的毒性。
In vivo siRNA给药方法大致分为系统给药(如静脉给药、腹腔给药等)和局部给药(如皮下注射,玻璃体给药,鞘内给药等)。siRNA系统给药每次注射5~20nmol/20g体重,局部给药则需每次注射1~5nmol/20g体重, 给药频率往往是一周2~3次,也可根据实验方案灵活设定给药剂量和频次,探索更佳的实验条件。
首先需要根据动物模型和实验方案,确定给药量和给药次数,然后计算出实验所需的总用量。需要根据不同的器官来选择给药方法,而给药量因不同给药方法和实验目的而异。如肝脏、肾脏、肌肉等常用静脉注射(系统给药);而皮下肿瘤则常用到瘤内注射(局部给药)。
局部给药(Local administration)
适用范围:浅表器官和组织,包括眼、肺、脑、肌肉、皮下组织、叶鞘组织等。
特点:最直接最常用的导入方式,siRNA 的导入效率较高,用量少,siRNA 能很快被吸收。因此,genOFFTM in vivo siRNA 在局部注射的应用中更有优势。
系统给药(Systemic administration)
适用范围:siRNA 具有广泛的组织分布,包括心、肝、肾、肺等。
特点:一些无法通过局部给药方式到达的靶位,如深入的内脏器官和一些散在分布的靶位(如淋巴细胞,转移性肿瘤细胞等),一般使用系统注射方式。
本期文章小编给大家更新了几篇关于in vivo siRNA给药方式的客户应用案例,希望能够对正在或即将要做动物实验的各位小伙伴有一定的帮助!
应用案例1:
Cell Death & Differentiation(IF12.4)丨DNA 5mC and RNA m6A modification successively facilitates the initiation and perpetuation stages of HSC activation in liver fibrosis progression
疾病模型:肝纤维化(将16只6周龄雄性C57BL/6小鼠随机分为两组,两组小鼠均通过腹腔注射10% CCl4 5 ml/kg,每周2次,连续4周,以建立肝纤维化模型)
动物模型:肝纤维化模型(分为2组,分别为CCl4 + siCON、CCl4 +siYTHDF1)
给药方式:弹丸式注射/尾静脉注射
给药剂量:10nmol
给药频率:每周两次,连续4周
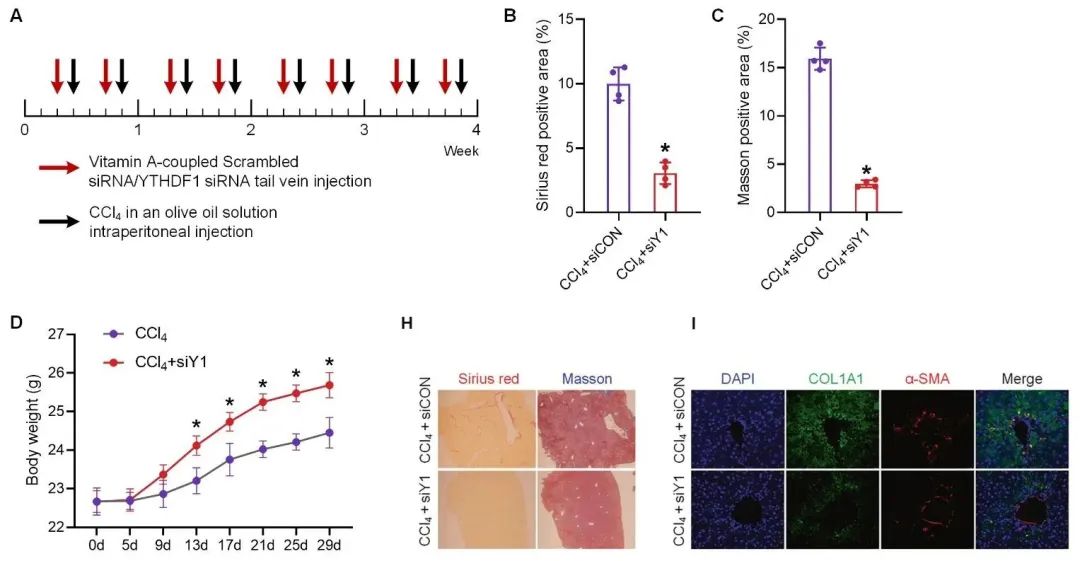
Fig1. 注射YTHDF1 siRNA显著减弱了CCl4诱导的小鼠体重减轻和肝胶原过度生成
参考文献:Feng Y, Guo S, Zhao Y, et al. DNA 5mC and RNA m6A modification successively facilitates the initiation and perpetuation stages of HSC activation in liver fibrosis progression[J]. Cell Death & Differentiation, 2023, 30(5): 1211-1220.
应用案例2:
Redox Biology(IF11.4)丨Pathologically high intraocular pressure induces mitochondrial dysfunction through Drp1 and leads to retinal ganglion cell PANoptosis in glaucoma
疾病模型:青光眼(通过将8周龄野生型C57BL/6J小鼠的眼内压提高到120 mmHg,并维持45 min来建立小鼠ph-IOP模型)
动物模型:ph-IOP小鼠模型(分为3组,分别注射ph-IOP、ph-IOP+Drp1-siRNA、 negative control)
给药方式:玻璃体内注射
给药剂量:2 nmol/eye
给药频率:构建ph-IOP模型前72h通过玻璃体进行注射,注射1次

Fig2. 通过玻璃体内注射siRNA对Drp1进行体内抑制可挽救ph-IOP诱导的视网膜神经节细胞泛凋亡
参考文献:Zeng Z, You M, Fan C, et al. Pathologically high intraocular pressure induces mitochondrial dysfunction through Drp1 and leads to retinal ganglion cell PANoptosis in glaucoma[J]. Redox Biology, 2023, 62: 102687.
应用案例3:
Redox Biology(IF11.4)丨Translocator protein 18 kDa regulates retinal neuron apoptosis and pyroptosis in glaucoma
动物模型:ph-IOP大鼠模型(分为6组,分别为ph-IOP、ph-IOP+miR-1839 agomir (Ago)、ph-IOP+miR-1839 antagomir (Anta)、ph-IOP+Ago+Ier2 siRNA (dIer2)、ph-IOP+Anta+dIer2、ph-IOP+dIer2+TSPO-siRNA (dTSPO))
给药方式:玻璃体内注射
给药剂量:2 nmol/eye
给药频率:在解剖显微镜下通过玻璃体内注射,注射1次

Fig3. 沉默TSPO可通过进一步抑制ph-IOP诱导的GCL细胞损失,增强Ier2敲低对RGCs的保护作用
参考文献:Zeng Z, You M, Rong R, et al. Translocator protein 18 kDa regulates retinal neuron apoptosis and pyroptosis in glaucoma[J]. Redox Biology, 2023, 63: 102713.
应用案例4:
Journal of Experimental & Clinical Cancer Research(IF11.3)丨TNFAIP2 confers cisplatin resistance in head and neck squamous cell carcinoma via KEAP1/NRF2 signaling
疾病模型:头颈部鳞状细胞癌(以6周龄C57BL/6小鼠为实验对象,连续给予含有50 mg/ml 4NQO的饮用水16周,然后给予正常饮用水6周,建立诱导的HNSCC模型)
动物模型:HNSCC小鼠模型(分为4组,分别注射si-control、cisplatin、si-Tnfaip2、cisplatin + si-Tnfaip2)
给药方式:瘤内注射
给药剂量:5 nM
给药频率:每4天注射一次,共4周

Fig4. 注射si-Tnfaip2导致肿瘤病变面积减少
参考文献:Xu T, Yang Y, Chen Z, et al. TNFAIP2 confers cisplatin resistance in head and neck squamous cell carcinoma via KEAP1/NRF2 signaling[J]. Journal of Experimental & Clinical Cancer Research, 2023, 42(1): 190.
应用案例5:
Cancer Letters(IF9.7)丨LINC00978 regulates metabolic rewiring to promote the malignancy of glioblastoma through AKR1B1
疾病模型:胶质母细胞瘤(将LN229细胞以1×105细胞/μL浓度悬浮于DMEM中,4周龄雄性裸鼠(5只/组)颅内注射5 μL细胞悬液,建立原位肿瘤模型)
动物模型:原位GBM异种移植模型(分为2组,分别注射scrambled siRNA、CamK-A siRNA)
给药方式:瘤内注射
给药剂量:/
给药频率:每10天注射一次,共注射4次

Fig5. 注射CamK-A siRNA导致肿瘤异种移植体积明显更小,显著抑制体内细胞增殖
参考文献:Meng M, Yang L, Zhou H, et al. LINC00978 regulates metabolic rewiring to promote the malignancy of glioblastoma through AKR1B1[J]. Cancer Letters, 2023: 216277.
应用案例6:
Cancer Letters(IF9.7)丨The feedback loop of AURKA/DDX5/TMEM147-AS1/let-7 drives lipophagy to induce cisplatin resistance in epithelial ovarian cancer
动物模型:PDX小鼠模型(分为4组,分别注射Saline+Cisplaitn+siNC、Saline+VX-680+siNC、Saline+Cisplaitn+siTMEM147-AS1、Saline+VX-680+siTMEM147-AS1)
给药方式:瘤内注射
给药剂量:5nmol
给药频率:每3天注射一次,共21天

Fig6. TMEM147-AS1体内siRNA和VX-680的组合使EOC对PDX小鼠模型中顺铂治疗敏感
参考文献:Shao Y, Li H, Wu Y, et al. The feedback loop of AURKA/DDX5/TMEM147-AS1/let-7 drives lipophagy to induce cisplatin resistance in epithelial ovarian cancer[J]. Cancer Letters, 2023, 565: 216241.
应用案例7:
Cell Death & Disease(IF9.0)丨LncRNA LINC00969 promotes acquired gefitinib resistance by epigenetically suppressing of NLRP3 at transcriptional and posttranscriptional levels to inhibit pyroptosis in lung cancer
疾病模型:肺癌(将5周龄雄性小鼠原位注射相同数量的PC9/GR细胞,以建立异种移植物模型)
动物模型:异种移植肿瘤模型(分为4组,分别注射control + siNC、gefitinib + siNC、control + si-LINC00969、gefitinib + si-LINC00969)
给药方式:瘤内注射
给药剂量:5nmol
给药频率:每4天注射一次,共4周

Fig7. 注射si-LINC00969组小鼠肿瘤体积明显减小,吉非替尼治疗后肿瘤体积进一步减小
参考文献:Dai J, Qu T, Yin D, et al. LncRNA LINC00969 promotes acquired gefitinib resistance by epigenetically suppressing of NLRP3 at transcriptional and posttranscriptional levels to inhibit pyroptosis in lung cancer[J]. Cell Death & Disease, 2023, 14(5): 312.
应用案例8:
Cell Death & Disease(IF9.0)丨LncRNA MALAT1 promotes growth and metastasis of head and neck squamous cell carcinoma by repressing VHL through a non-canonical function of EZH2
疾病模型:头颈部鳞状细胞癌(将5×105个SCC15细胞注射到5周龄BALB/c雄性裸鼠的脚背,以建立异种移植小鼠模型)
动物模型:异种移植肿瘤模型(分为2组,分别注射NC、si-MALAT1)
给药方式:瘤内注射
给药剂量:5 nmol/20 g
给药频率:每4天注射一次,共12次
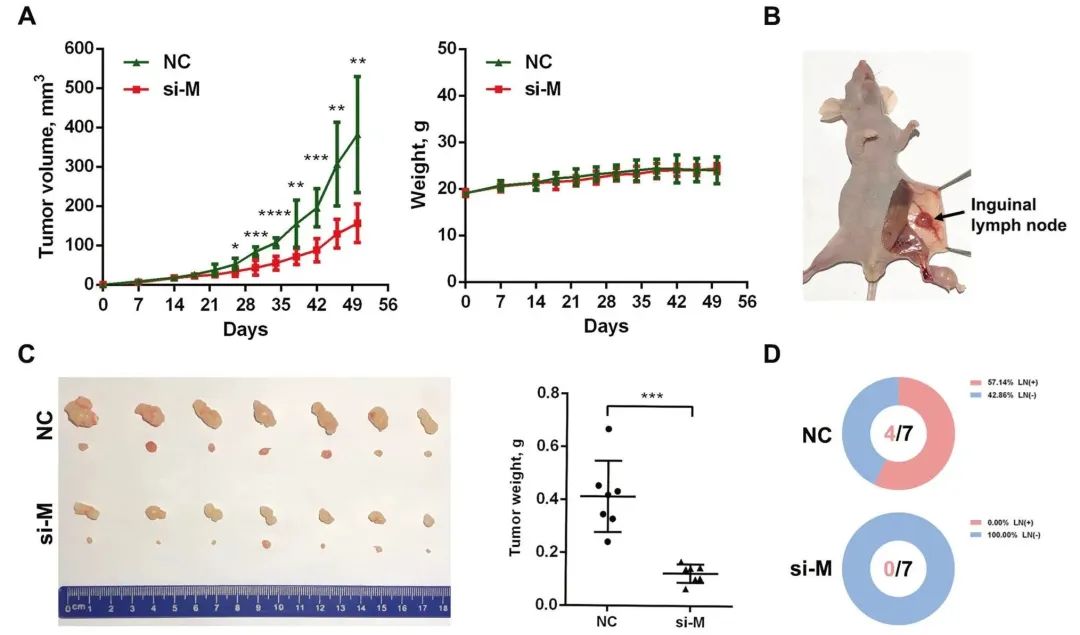
Fig8. 注射si-MALAT1显著抑制异种移植物的肿瘤生长
参考文献:Duan Y, Yue K, Ye B, et al. LncRNA MALAT1 promotes growth and metastasis of head and neck squamous cell carcinoma by repressing VHL through a non-canonical function of EZH2[J]. Cell Death & Disease, 2023, 14(2): 149.
应用案例9:
Molecular Therapy-Nucleic Acids(IF8.8)丨Chemically modified small interfering RNA targeting Hedgehog signaling pathway for rheumatoid arthritis therapy
疾病模型:类风湿性关节炎(第0天在DBA/1小鼠尾根部皮下注射用50 μL完全弗氏佐剂乳化的牛II型胶原蛋白100 μg作为初次免疫。第21天,小鼠接受不完全弗氏佐剂乳化的牛II型胶原加强免疫,以建立关节炎模型)
动物模型:CIA小鼠模型(分为4组,分别为normal control、CIA control、si-Scr-Chol、si-S1A3-Chol)
给药方式:关节内注射
给药剂量:250 nmol/kg·bw
给药频率:每周1次,连续8周

Fig9. 注射胆固醇偶联的化学修饰siRNA改善CIA小鼠关节炎进展并维持步态功能
参考文献:Lin L, Zhu S, Huang H, et al. Chemically modified small interfering RNA targeting Hedgehog signaling pathway for rheumatoid arthritis therapy[J]. Molecular Therapy-Nucleic Acids, 2023, 31: 88-104.
应用案例10:
The Journal of Headache and Pain(IF7.4)丨Trace amine-associated receptor 1 regulation of Kv1. 4 channels in trigeminal ganglion neurons contributes to nociceptive behaviors
动物模型:电刺激上矢状窦周围硬脑膜诱导的偏头痛小鼠模型(分为2组,分别为Kv1.4-siRNA、NC-siRNA)
给药方式:三叉神经节内注射
给药剂量:3 ul
给药频率:针尖终止于TG内侧,药物/试剂在5分钟内将3μl体积缓慢注射到TG内
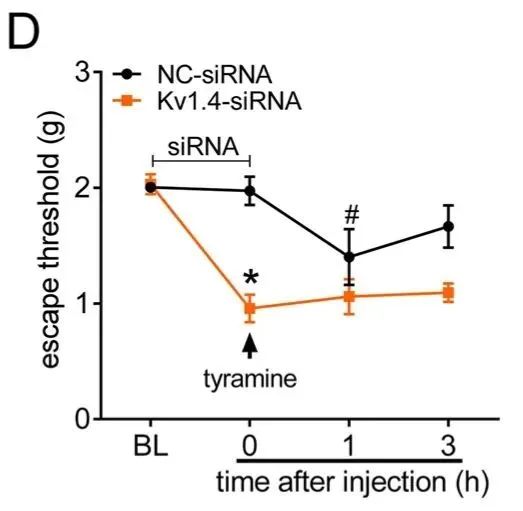
Fig10. TG内给药Kv1.4-siRNA后导致机械灵敏度显著增加,进一步施用1 nmol酪胺显着增加了NC-siRNA组的机械疼痛敏感性,而对Kv1.4-siRNA组的机械疼痛敏感性没有加性作用
参考文献:Zhang Y, Wang H, Sun Y, et al. Trace amine-associated receptor 1 regulation of Kv1. 4 channels in trigeminal ganglion neurons contributes to nociceptive behaviors[J]. The Journal of Headache and Pain, 2023, 24(1): 1-18.
更多动物用siRNA应用案例持续更新中,敬请期待……