推荐产品
公司新闻/正文
Mol Cancer丨M6A介导的circMDK上调促进肿瘤发生,是HCC的纳米治疗靶点
人阅读 发布时间:2022-05-10 10:32
肝细胞癌(HCC)是全球第五大常见癌症,也是癌症死亡的第二大原因。尽管在诊断、手术技术、靶向治疗和免疫治疗方面取得了快速进展,但HCC患者的5年总生存率仍然不理想,这主要是由于复发性远端转移和对抗肿瘤药物的耐药性。HCC肿瘤发生、转移和耐药的潜在分子机制仍不清楚。因此,鉴定预后生物标志物,探索HCC肿瘤发生和进展的潜在机制,开发靶向治疗手段是至关重要的。
环状RNAs(circRNAs)是一类由内含子或外显子通过反向剪接产生的内源性非编码RNAs。它们具有共价闭合环,无5’端帽和3’端polyA尾。许多研究表明,circRNAs可以充当microRNAs(miRNAs)的海绵或与蛋白质结合,并且circRNA水平的改变会导致基因产物的异常表达。越来越多的研究发现,circRNAs在哺乳动物中广泛表达,并且在各种癌症中均有不同程度的表达,例如食管鳞状细胞癌、尿路上皮癌和结直肠癌。此外,一些circRNAs已被报道参与了HCC的发展,调节细胞增殖、肿瘤转移和糖酵解。最近的研究阐明了一些circRNA在HCC中的作用。例如,circASAP1通过充当miR-326和miR-532-5p的海绵增强MAPK1和CSF-1的表达,从而促进HCC的生长和肺转移,而circDLC1通过circDLC1-HuR-MMP1轴抑制HCC的发展和进展,可作为HCC的潜在治疗靶点。CircRNA-SORE通过抑制Wnt/β-catenin通路增加HCC细胞对索拉非尼的敏感性。然而,HCC相关的circRNAs是否通过其他调节机制发挥致瘤作用仍有待探索。
N6-甲基腺苷(m6A)修饰作为表观遗传调控的一个新领域,具有调节剪接、输出、蛋白质翻译、稳定性和肿瘤发生等多种功能,越来越受到人们的关注。m6A RNA甲基化是哺乳动物中最普遍的mRNA内部修饰,由m6A甲基转移酶(METTL3/14、WTAP、RBM15/15B、KIAA1429、VIRMA和ZC3H13,称为“writers”)、去甲基化酶(FTO、ALKBH5和ALKBH3,称为“erasers”)或m6A结合蛋白(YTHDC1/2、YTHDF1/3、IGF2BP1/3、HNRNP和eIF3,称为“readers”)。其中一些成员(例如METTL3、FTO和IGF2BPs)积极参与各种人类癌症,如急性淋巴细胞白血病、乳腺癌和子宫内膜癌。m6A和circRNAs之间的桥梁已经被建立。例如,主要定位于细胞质的m6A介导的circRNA可导致mRNA稳定性增强或蛋白质翻译增加。例如,METTL3依赖性m6A参与了DGCR8介导的miR126和pri-miR126的成熟。在HCC细胞中,KIAA1429可以诱导GATA3的m6A甲基化,促进恶性表型。尽管如此,m6A修饰的circRNAs在HCC中的作用仍需进一步研究。
近年来,基因组研究的显著进展使基因治疗成为一种治疗癌症的新方法。RNA干扰(RNAi)是一种调节靶基因的方法,有望开发出新型分子治疗药物,这些药物编码了常规疗法不适用的“非药物”靶标。RNAi分子可分为miRNA、小干扰RNA(siRNA)和短发夹RNA(shRNA)。其中,siRNA由于其强大且特异性的RNAi触发活性而显示出巨大的核酸治疗潜力。SiRNA是一种短的双链RNAs,能够使互补信使RNAs(mRNAs)进行序列特异性基因沉默,诱导mRNA降解并抑制靶蛋白的产生。基于siRNA的疗法已成为一种有前景的可用于靶向多种疾病的策略。然而,裸露siRNA的基因沉默效率非常低,因为裸露siRNA分子会被血液中的核酸酶迅速降解,并在体内迅速被肾脏清除。此外,siRNA的大尺寸和负电荷阻碍了其渗透到细胞膜并阻止其在细胞内积累。因此,有效的递送是将siRNA引入到靶细胞和组织的关键问题。为了有效地传递siRNA,已经开发了各种材料,包括脂质、聚合物、树枝状大分子、聚合物胶束和金属核纳米颗粒(NPs)。有趣的是,聚(β-氨基酯)(PAEs)为规避siRNA有效递送的困难提供了前景。PAEs是一类重要的可生物降解合成聚合物,可被细胞内酯酶降解,从而显着提高生物相容性。考虑到它们的pH敏感性、高生物相容性以及用于灵活合成和基因装载的结构多样性,它们已被研究用于作为基因和药物递送载体以及组织工程支架。
近日,Molecular Cancer(IF27.401)期刊发表了一篇题为M6A-mediated upregulation of circMDK promotes tumorigenesis and acts as a nanotherapeutic target in hepatocellular carcinoma的研究论文。文章报道了一个新型致癌circRNA circMDK,其表达上调与m6A修饰相关,并揭示了其通过miR-346/874-3p-ATG16L1轴促进HCC进展的分子机制。此外,PAEs介导的circMDK siRNA(PAE-siRNA)体内递送显著减弱了HCC小鼠模型中的肿瘤进展,暗示circMDK可能作为HCC的潜在生物标志物,并为HCC的治疗提供了一种有前途的纳米治疗策略。

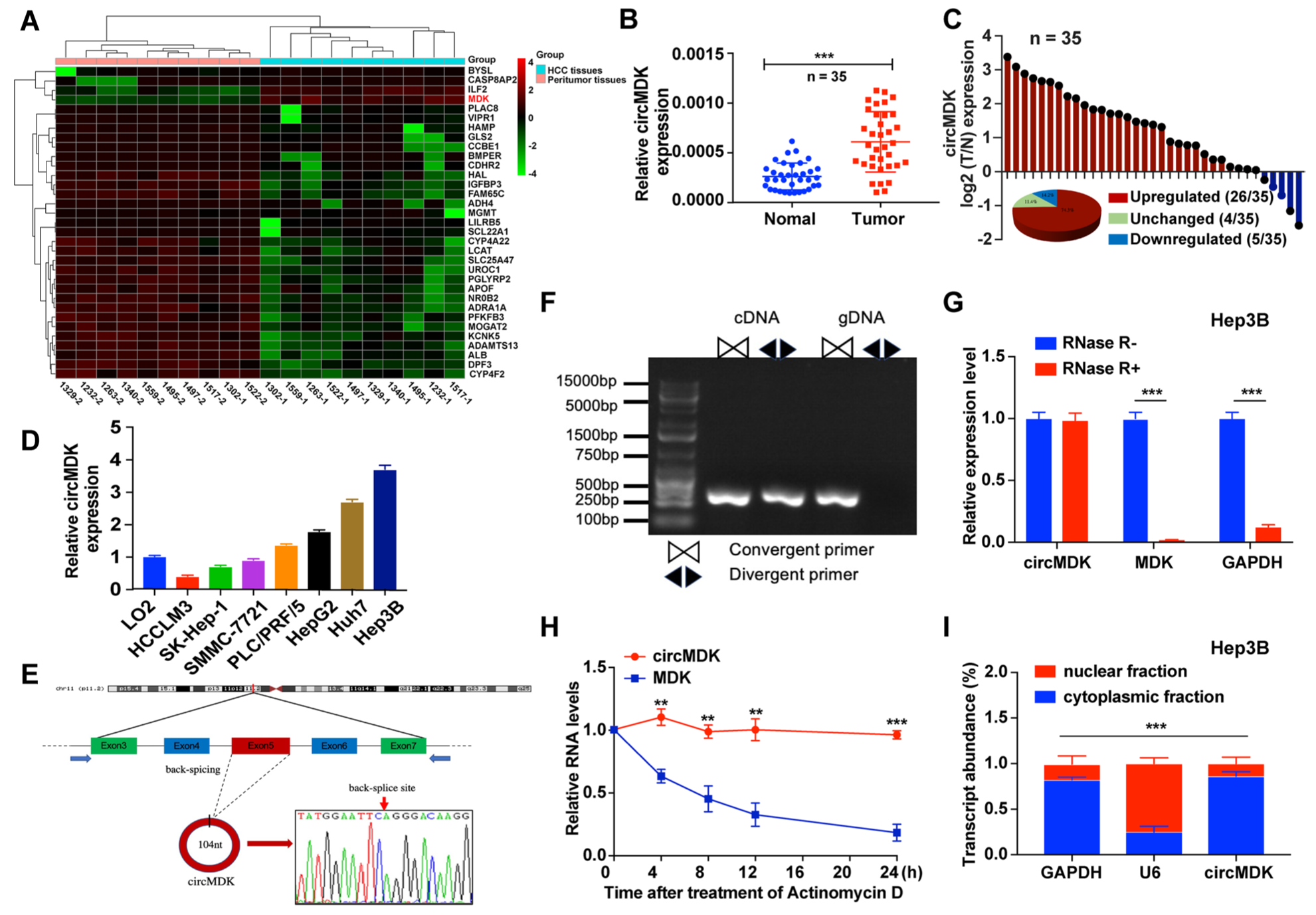
首先,为了研究circRNAs在HCC肿瘤发生中的作用,研究人员对10对HCC和邻近非癌肝脏(ANL)组织进行RNA-seq分析。结果发现,与ANL组织相比,在HCC中共检测到92,204个不同的circRNAs,其中4个上调,38个下调。基于失调circRNAs的差异表达水平,研究人员发现hsa_circ_0095868(来源于MDK基因的exon 5,命名为circMDK)显著上调,HCC组织/细胞中的qRT-PCR实验进一步证实了这一结果。随后,研究人员分析了circMDK表达与HCC患者预后之间的关系,结果显示circMDK表达较高的患者预后较差。此外,研究人员通过Sanger测序、PCR分析、RNase R消化、半衰期分析、核质分离和RNA FISH对circMDK进行了表征,证实了circMDK是丰富的、环状的、稳定的转录本,并且在HCC中显著上调,主要位于细胞质中。
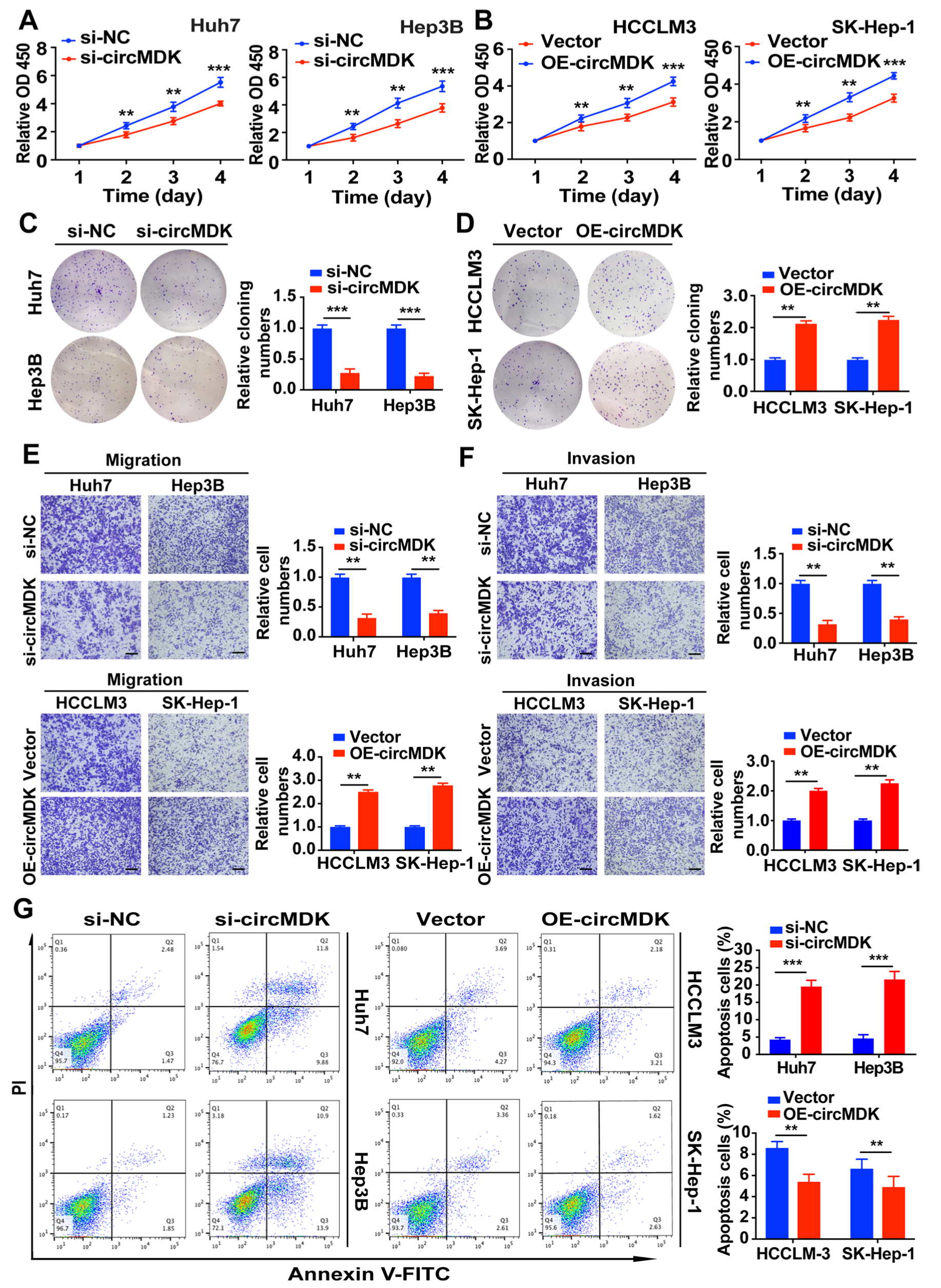
接下来,为了探讨circMDK在体外HCC进展中的作用,研究人员使用siRNA和过表达载体进行功能缺失性和获得性实验。结果显示沉默circMDK显著降低了HCC细胞的增殖、迁移和侵袭能力,增加了HCC细胞的凋亡率;过表达circMDK则产生相反的结果。
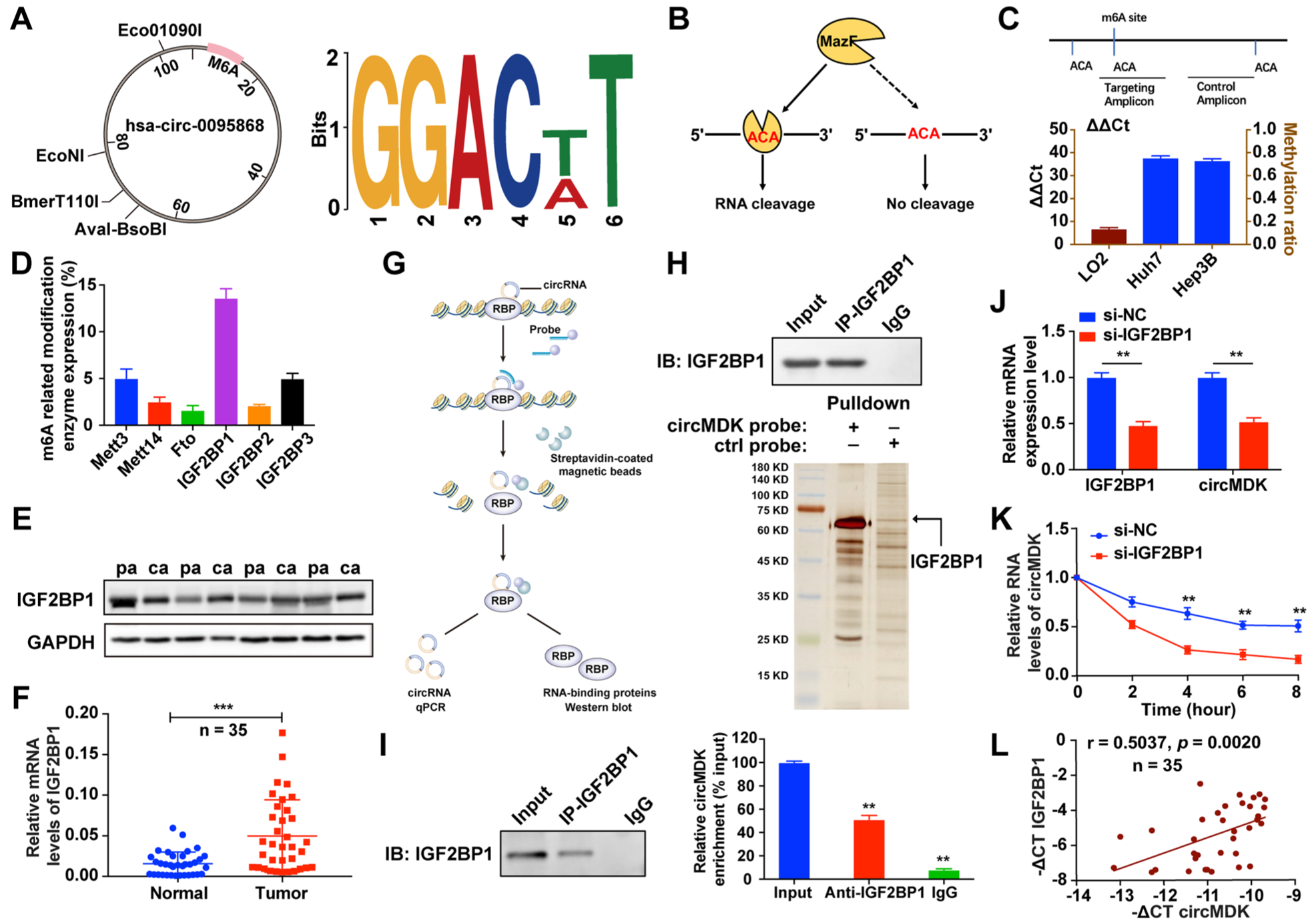
紧接着,为了探索circMDK是否经历m6A修饰,研究人员首先使用在线生物信息学工具m6A Avar预测了circMDK中的m6A位点,并在circMDK的exon 5位点发现了一个RRACU m6A序列基序。进一步的研究发现IGF2BP1蛋白是circMDK的m6A结合蛋白,且IGF2BP1在HCC组织中高表达。随后,研究人员通过RNA pull-down和免疫沉淀实验证实了circMDK和IGF2BP1的相互作用。此外,circMDK与IGF2BP1的表达呈正相关,IGF2BP1的下调导致circMDK表达降低,且沉默IGF2BP1降低了circMDK的RNA稳定性。表明circMDK的m6A修饰增强了转录组稳定性。
机制研究表明,circMDK通过充当miR-346和miR-874-3p的分子海绵来上调miR-346和miR-874-3p共同的靶基因ATG16L1(自噬相关16样蛋白1),从而激活PI3K/AKT/mTOR信号通路,最终通过形成的circMDK-mir-346/miR-874-3p-ATG16L1-PI3K/AKT/mTOR信号通路促进细胞增殖、迁移、侵袭并抑制细胞凋亡。

最后,考虑到circMDK上调在HCC中的关键作用,研究人员试图开发一种靶向circMDK的有效siRNA递送载体,作为HCC的潜在疗法。为此,研究人员合成了PAEs以协助递送circMDK siRNA(PAE-siRNA)。结果显示,在包括皮下、转移、原位和患者源性异种移植(PDX)肝肿瘤模型中,递送PAE-siRNA有效地抑制了HCC肿瘤进展,且无明显不良反应。

总之,本研究结果证明了circMDK是一种致癌circRNA,并通过circMDK-miR-346/miR-874-3p-ATG16L1轴在HCC的肿瘤发生和进展中发挥重要作用。本研究首次证明了一种通过靶向circRNA的PAE-siRNA复合物直接有效地抑制HCC的方法,这为HCC提供了一种有前途的纳米治疗选择。
原文链接:
https://molecular-cancer.biomedcentral.com/articles/10.1186/s12943-022-01575-z
本研究使用到的miRNA靶基因3’UTR载体、miRNA mimics和inhibitors、TG16L1 siRNA和circMDK siRNA、5端cy5标记circMDK siRNA、FISH探针、FAM标记miRNA探针等产品均由锐博生物提供!更多circRNA研究产品与服务,欢迎登陆锐博生物官网(www.ribobio.com)查看或来电咨询!
环状RNAs(circRNAs)是一类由内含子或外显子通过反向剪接产生的内源性非编码RNAs。它们具有共价闭合环,无5’端帽和3’端polyA尾。许多研究表明,circRNAs可以充当microRNAs(miRNAs)的海绵或与蛋白质结合,并且circRNA水平的改变会导致基因产物的异常表达。越来越多的研究发现,circRNAs在哺乳动物中广泛表达,并且在各种癌症中均有不同程度的表达,例如食管鳞状细胞癌、尿路上皮癌和结直肠癌。此外,一些circRNAs已被报道参与了HCC的发展,调节细胞增殖、肿瘤转移和糖酵解。最近的研究阐明了一些circRNA在HCC中的作用。例如,circASAP1通过充当miR-326和miR-532-5p的海绵增强MAPK1和CSF-1的表达,从而促进HCC的生长和肺转移,而circDLC1通过circDLC1-HuR-MMP1轴抑制HCC的发展和进展,可作为HCC的潜在治疗靶点。CircRNA-SORE通过抑制Wnt/β-catenin通路增加HCC细胞对索拉非尼的敏感性。然而,HCC相关的circRNAs是否通过其他调节机制发挥致瘤作用仍有待探索。
N6-甲基腺苷(m6A)修饰作为表观遗传调控的一个新领域,具有调节剪接、输出、蛋白质翻译、稳定性和肿瘤发生等多种功能,越来越受到人们的关注。m6A RNA甲基化是哺乳动物中最普遍的mRNA内部修饰,由m6A甲基转移酶(METTL3/14、WTAP、RBM15/15B、KIAA1429、VIRMA和ZC3H13,称为“writers”)、去甲基化酶(FTO、ALKBH5和ALKBH3,称为“erasers”)或m6A结合蛋白(YTHDC1/2、YTHDF1/3、IGF2BP1/3、HNRNP和eIF3,称为“readers”)。其中一些成员(例如METTL3、FTO和IGF2BPs)积极参与各种人类癌症,如急性淋巴细胞白血病、乳腺癌和子宫内膜癌。m6A和circRNAs之间的桥梁已经被建立。例如,主要定位于细胞质的m6A介导的circRNA可导致mRNA稳定性增强或蛋白质翻译增加。例如,METTL3依赖性m6A参与了DGCR8介导的miR126和pri-miR126的成熟。在HCC细胞中,KIAA1429可以诱导GATA3的m6A甲基化,促进恶性表型。尽管如此,m6A修饰的circRNAs在HCC中的作用仍需进一步研究。
近年来,基因组研究的显著进展使基因治疗成为一种治疗癌症的新方法。RNA干扰(RNAi)是一种调节靶基因的方法,有望开发出新型分子治疗药物,这些药物编码了常规疗法不适用的“非药物”靶标。RNAi分子可分为miRNA、小干扰RNA(siRNA)和短发夹RNA(shRNA)。其中,siRNA由于其强大且特异性的RNAi触发活性而显示出巨大的核酸治疗潜力。SiRNA是一种短的双链RNAs,能够使互补信使RNAs(mRNAs)进行序列特异性基因沉默,诱导mRNA降解并抑制靶蛋白的产生。基于siRNA的疗法已成为一种有前景的可用于靶向多种疾病的策略。然而,裸露siRNA的基因沉默效率非常低,因为裸露siRNA分子会被血液中的核酸酶迅速降解,并在体内迅速被肾脏清除。此外,siRNA的大尺寸和负电荷阻碍了其渗透到细胞膜并阻止其在细胞内积累。因此,有效的递送是将siRNA引入到靶细胞和组织的关键问题。为了有效地传递siRNA,已经开发了各种材料,包括脂质、聚合物、树枝状大分子、聚合物胶束和金属核纳米颗粒(NPs)。有趣的是,聚(β-氨基酯)(PAEs)为规避siRNA有效递送的困难提供了前景。PAEs是一类重要的可生物降解合成聚合物,可被细胞内酯酶降解,从而显着提高生物相容性。考虑到它们的pH敏感性、高生物相容性以及用于灵活合成和基因装载的结构多样性,它们已被研究用于作为基因和药物递送载体以及组织工程支架。
近日,Molecular Cancer(IF27.401)期刊发表了一篇题为M6A-mediated upregulation of circMDK promotes tumorigenesis and acts as a nanotherapeutic target in hepatocellular carcinoma的研究论文。文章报道了一个新型致癌circRNA circMDK,其表达上调与m6A修饰相关,并揭示了其通过miR-346/874-3p-ATG16L1轴促进HCC进展的分子机制。此外,PAEs介导的circMDK siRNA(PAE-siRNA)体内递送显著减弱了HCC小鼠模型中的肿瘤进展,暗示circMDK可能作为HCC的潜在生物标志物,并为HCC的治疗提供了一种有前途的纳米治疗策略。

首先,为了研究circRNAs在HCC肿瘤发生中的作用,研究人员对10对HCC和邻近非癌肝脏(ANL)组织进行RNA-seq分析。结果发现,与ANL组织相比,在HCC中共检测到92,204个不同的circRNAs,其中4个上调,38个下调。基于失调circRNAs的差异表达水平,研究人员发现hsa_circ_0095868(来源于MDK基因的exon 5,命名为circMDK)显著上调,HCC组织/细胞中的qRT-PCR实验进一步证实了这一结果。随后,研究人员分析了circMDK表达与HCC患者预后之间的关系,结果显示circMDK表达较高的患者预后较差。此外,研究人员通过Sanger测序、PCR分析、RNase R消化、半衰期分析、核质分离和RNA FISH对circMDK进行了表征,证实了circMDK是丰富的、环状的、稳定的转录本,并且在HCC中显著上调,主要位于细胞质中。

Fig1. CircMDK表达谱显示circMDK在HCC中上调
接下来,为了探讨circMDK在体外HCC进展中的作用,研究人员使用siRNA和过表达载体进行功能缺失性和获得性实验。结果显示沉默circMDK显著降低了HCC细胞的增殖、迁移和侵袭能力,增加了HCC细胞的凋亡率;过表达circMDK则产生相反的结果。

Fig2. circMDK在HCC细胞中促进细胞增殖、迁移、侵袭,阻碍细胞凋亡
紧接着,为了探索circMDK是否经历m6A修饰,研究人员首先使用在线生物信息学工具m6A Avar预测了circMDK中的m6A位点,并在circMDK的exon 5位点发现了一个RRACU m6A序列基序。进一步的研究发现IGF2BP1蛋白是circMDK的m6A结合蛋白,且IGF2BP1在HCC组织中高表达。随后,研究人员通过RNA pull-down和免疫沉淀实验证实了circMDK和IGF2BP1的相互作用。此外,circMDK与IGF2BP1的表达呈正相关,IGF2BP1的下调导致circMDK表达降低,且沉默IGF2BP1降低了circMDK的RNA稳定性。表明circMDK的m6A修饰增强了转录组稳定性。

Fig3. IGF2BP1识别m6A修饰的circMDK并提高circMDK的转录稳定性
机制研究表明,circMDK通过充当miR-346和miR-874-3p的分子海绵来上调miR-346和miR-874-3p共同的靶基因ATG16L1(自噬相关16样蛋白1),从而激活PI3K/AKT/mTOR信号通路,最终通过形成的circMDK-mir-346/miR-874-3p-ATG16L1-PI3K/AKT/mTOR信号通路促进细胞增殖、迁移、侵袭并抑制细胞凋亡。

Fig4. circMDK通过mir-346/ 874-3p-ATG16L1轴促进HCC进展的机制示意图
最后,考虑到circMDK上调在HCC中的关键作用,研究人员试图开发一种靶向circMDK的有效siRNA递送载体,作为HCC的潜在疗法。为此,研究人员合成了PAEs以协助递送circMDK siRNA(PAE-siRNA)。结果显示,在包括皮下、转移、原位和患者源性异种移植(PDX)肝肿瘤模型中,递送PAE-siRNA有效地抑制了HCC肿瘤进展,且无明显不良反应。

Fig5. PAE-siRNA复合物在原位模型中的抗肿瘤效果
总之,本研究结果证明了circMDK是一种致癌circRNA,并通过circMDK-miR-346/miR-874-3p-ATG16L1轴在HCC的肿瘤发生和进展中发挥重要作用。本研究首次证明了一种通过靶向circRNA的PAE-siRNA复合物直接有效地抑制HCC的方法,这为HCC提供了一种有前途的纳米治疗选择。
原文链接:
https://molecular-cancer.biomedcentral.com/articles/10.1186/s12943-022-01575-z
本研究使用到的miRNA靶基因3’UTR载体、miRNA mimics和inhibitors、TG16L1 siRNA和circMDK siRNA、5端cy5标记circMDK siRNA、FISH探针、FAM标记miRNA探针等产品均由锐博生物提供!更多circRNA研究产品与服务,欢迎登陆锐博生物官网(www.ribobio.com)查看或来电咨询!