推荐产品
公司新闻/正文
miRNA新研究进展盘点(20220421)
人阅读 发布时间:2022-04-21 09:37
Genetic Deficiency of MicroRNA-15a/16-1 Confers Resistance to Neuropathological Damage and Cognitive Dysfunction in Experimental Vascular Cognitive Impairment and Dementia
MicroRNA-15a/16-1的遗传缺陷赋予对实验性血管性认知障碍和痴呆症的神经病理学损伤和认知功能障碍的抵抗力
发表期刊:Adv Sci (Weinh)
影响因子:16.806
发表时间:2022年4月11日
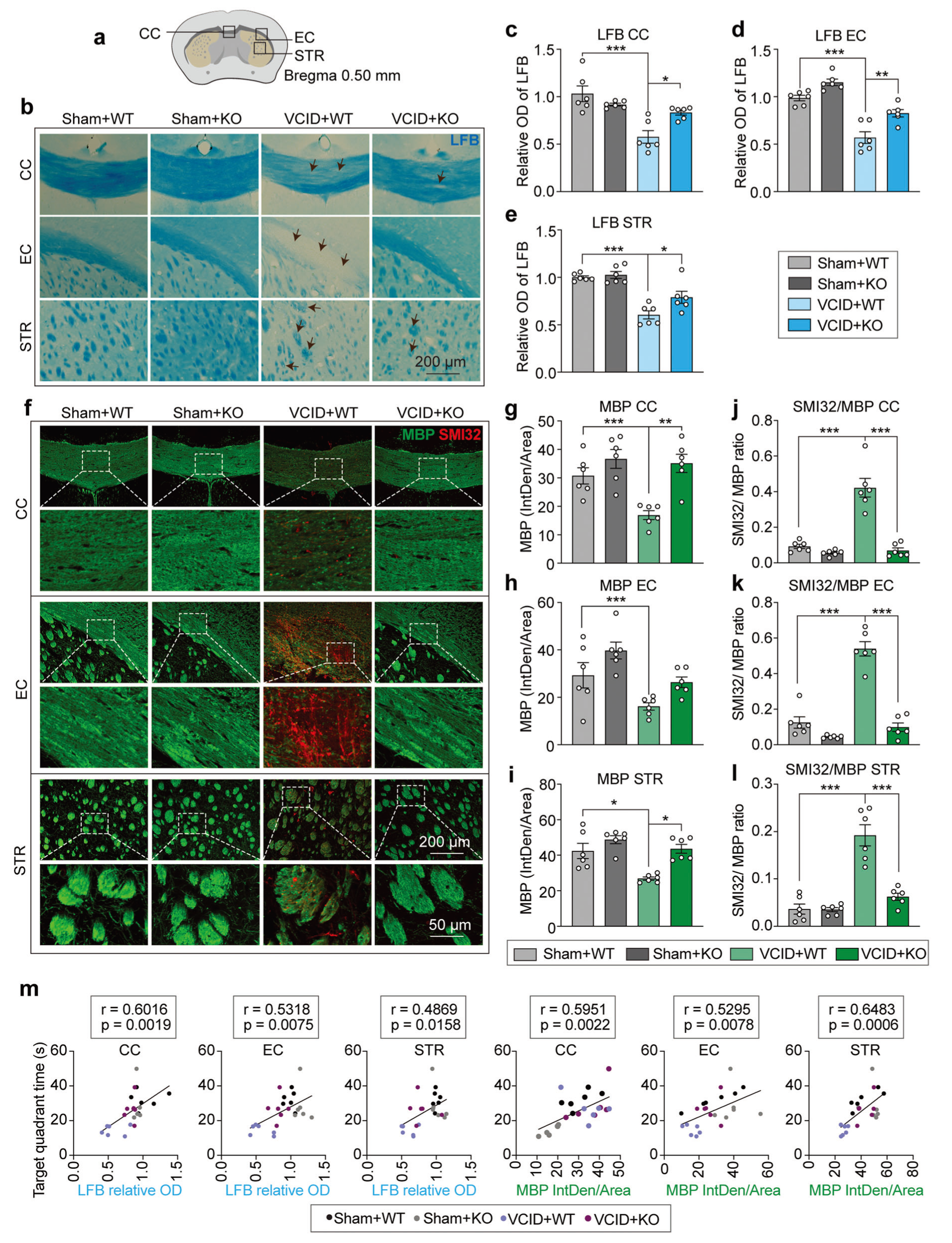
慢性脑灌注不足导致的脑损伤有助于血管性认知障碍和痴呆(VCID)的进展。累积证据表明,microRNAs(miRs)正在成为CNS疾病的新治疗靶点。本研究旨在确定miR-15a/16-1在VCID中的调节作用。研究发现miR-15a/16-1敲除(KO)小鼠在VCID后表现出较少的认知和感觉运动缺陷。VCID小鼠中miR-15a/16-1的遗传缺陷也可减轻髓鞘变性、轴突损伤和神经元缺失。机制上,miR-15a/16-1与AKT3和IL-10RA的3'-UTR结合。miR-15a/16-1的遗传缺失增加了VCID大脑中AKT3和IL-10RA的表达,而鼻内递送负载AKT3和IL-10RA siRNA的纳米颗粒部分降低了VICD后miR-15a/16-1 KO小鼠的脑保护和认知恢复。总之,miR-15a/16-1-IL/10RA/AKT3轴在调节VCID后的血管性脑损伤和认知能力下降中起关键作用。靶向miR-15a/16-1是一种治疗VCID的新型治疗方法。
原文链接:https://pubmed.ncbi.nlm.nih.gov/35403823/
Aberrant miR-339-5p/neuronatin signaling causes prodromal neuronal calcium dyshomeostasis in mutant presenilin mice
异常的miR-339-5p/neuronatin信号导致突变型早老素小鼠的前驱病状神经元钙稳态失衡
发表期刊:J Clin Invest
影响因子:14.808
发表时间:2022年4月15日
大量出现脊柱丢失和钙稳态失衡是与年龄相关的神经退行性变(例如阿尔茨海默病,AD)的早期标志性事件,这与认知大脑区域早期病理学中的神经元过度活跃有关。然而,这些关键事件是如何在分子水平上触发疾病初始阶段发生的神经元异常的,目前仍不清楚。本研究在家族性AD(FAD)的早老素-1 M146V敲入(PSEN1-M146V KI)小鼠模型的皮层神经元中鉴定出下调的miR-339-5p及其靶蛋白neuronatin(Nnat)的上调。抑制miR-339-5p或过表达Nnat可重现PSEN1突变的皮质神经元中的脊柱缺失和内质网钙超载。相反,miR-339-5p的过表达或Nnat的敲低可恢复脊柱形态发生和钙稳态。研究人员使用光纤光度法记录了客体认知过程,进一步证明PSEN1突变体导致脾后皮层神经元反应的习惯化缺陷,这可以通过恢复miR-339-5p/Nnat通路来挽救。因此,本研究结果揭示了miR-339-5p/Nnat通路在FAD中的关键作用,可作为早期发病机制的潜在诊断和治疗靶点。

原文链接:https://pubmed.ncbi.nlm.nih.gov/35426376/
Microtubules promote the non-cell autonomous action of microRNAs by inhibiting their cytoplasmic loading onto ARGONAUTE1 in Arabidopsis
微管可促进拟南芥中microRNA的非细胞自主作用
发表期刊:Dev Cell
影响因子:12.270
发表时间:2022年4月7日
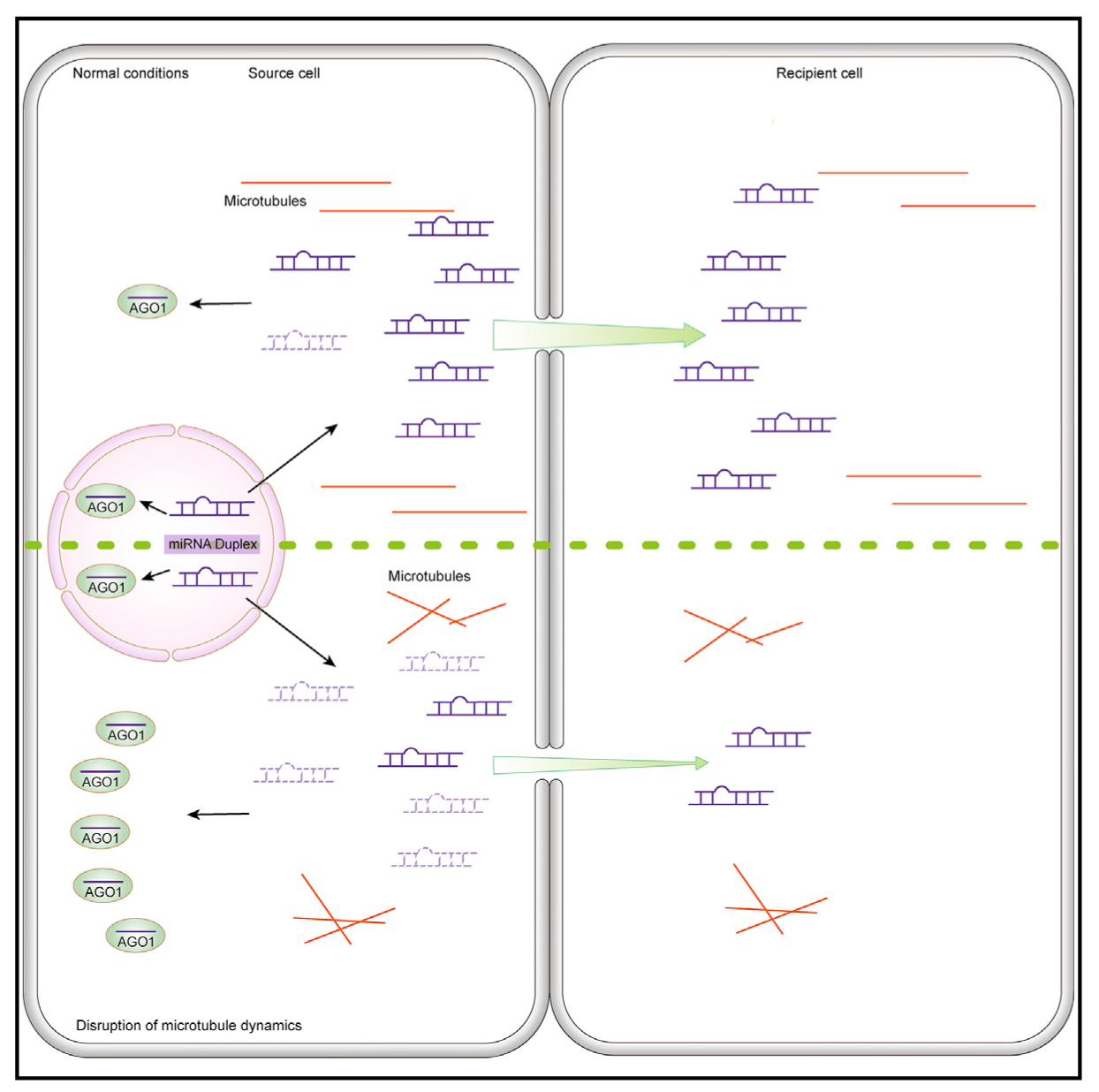
移动microRNAs(miRNAs)在植物的发育模式和胁迫应答中起着局部和远程信号的作用。然而,控制miRNAs非细胞自主活动的机制仍然不清楚。本研究表明,在拟南芥根中,破坏微管动力学的突变对于移动miRNAs的非细胞自主行为是有特异性缺陷的,其中包括miR165/6,其在内皮层中产生并移动到脉管系统以确定木质部细胞命运。研究表明,源细胞(source cells)中需要KTN1(一种微管切断酶的亚基)来抑制miR165/6装载到细胞自主的ARGONUATE1(AGO1)中,以使miRNA能够离开细胞。微管破坏增强了细胞质中miR165/6与AGO1的关联。这些发现表明,虽然细胞核中细胞自主的miRNAs装载到AGO1上,但移动miRNAs的细胞质AGO1装载是微管调节以促进miRNA在细胞间运动范围的关键步骤。
原文链接:https://pubmed.ncbi.nlm.nih.gov/35429434/
MicroRNA networks in FLT3-ITD acute myeloid leukemia
FLT3-ITD急性髓系白血病中的MicroRNA网络
发表期刊:Proc Natl Acad Sci U S A
影响因子:11.205
发表时间:2022年4月19日
MiR-126和miR-155是分别调节造血细胞静止和增殖的关键microRNAs(miRNAs)。本研究发现在急性髓系白血病(AML)中,这两种miRNAs的生物发生是通过一个由FLT3-ITD(FMS样酪氨酸激酶3-内部串联重复)驱动的调节环网络相互连接的。事实上,FLT3-ITD通过一种涉及细胞质Drosha核糖核酸酶III(DROSHA)的非典型miRNA生物发生机制诱导miR-155的表达。反过来,miR-155下调SHIP1(含SH2结构域的肌醇磷酸酶1),从而增加磷蛋白激酶B(AKT),进而丝氨酸磷酸化、稳定和激活SPRED1(Sprouty相关EVH1域包含1)。激活的SPRED1抑制RAN/XPO5复合物并阻断pre-miR-126从细胞核到细胞质的转运,从而无法完成生物发生的最后步骤。最终结果是异常低水平的成熟miR-126允许静止的白血病细胞被募集到细胞周期中并增殖。因此,增殖性AML原始细胞中miR-126的下调是FLT3-ITD依赖性miR-155表达的下游,该表达启动了一个复杂的串联调节反馈回路(即miR-126/SPRED1、miR-155/ DDX3X)和前馈(即miR-155/SHIP1/AKT/miR-126)调节环,最终汇聚成白血病生长的输出信号。
原文链接:https://pubmed.ncbi.nlm.nih.gov/35412895/
Mouse mesenchymal stem cell-derived exosomal miR-466f-3p reverses EMT process through inhibiting AKT/GSK3β pathway via c-MET in radiation-induced lung injury
小鼠间充质干细胞来源的外泌体miR-466f-3p在放射性肺损伤中通过c-MET抑制AKT/GSK3β通路逆转EMT过程
发表期刊:J Exp Clin Cancer Res
影响因子:11.161
发表时间:2022年4月7日
背景:放射性肺纤维化(RILF)是胸部放射治疗的常见并发症。肺泡上皮细胞通过上皮-间充质转化(EMT)在肺纤维化中起关键作用。源自间充质干细胞的外泌体具有修复和再生受损组织的有益特性,但其潜在机制仍知之甚少。
结果:mMSCs-Exos在90-150 nm范围内有效分离,并具有高表达的外泌体标志物(CD63、TSG101和CD9)。mMSCs-Exos给药可有效缓解辐射引起的肺损伤,胶原沉积较少,IL-1β和IL-6水平较低。同时,体外实验结果表明,mMSCs-Exos治疗明显逆转了辐射诱导的EMT过程。在外泌体中富集的miRNA装载物中,miR-466f-3p主要负责通过抑制AKT/GSK3β通路产生保护作用。机制研究进一步表明,c-MET是miR-466f-3p的直接靶标,其恢复部分消除了mMSCs-Exo介导的对EMT过程和辐射诱导的AKT/GSK3β信号活性的抑制。
结论:研究结果表明,源自mMSCs的外泌体miR-466f-3p可能具有抗纤维化特性,并通过c-MET抑制AKT/GSK3β来预防辐射诱导的EMT,为辐射诱导的肺纤维化提供了一种有前景的治疗方式。

原文链接:https://pubmed.ncbi.nlm.nih.gov/35392967/
MicroRNA-15a/16-1的遗传缺陷赋予对实验性血管性认知障碍和痴呆症的神经病理学损伤和认知功能障碍的抵抗力
发表期刊:Adv Sci (Weinh)
影响因子:16.806
发表时间:2022年4月11日
慢性脑灌注不足导致的脑损伤有助于血管性认知障碍和痴呆(VCID)的进展。累积证据表明,microRNAs(miRs)正在成为CNS疾病的新治疗靶点。本研究旨在确定miR-15a/16-1在VCID中的调节作用。研究发现miR-15a/16-1敲除(KO)小鼠在VCID后表现出较少的认知和感觉运动缺陷。VCID小鼠中miR-15a/16-1的遗传缺陷也可减轻髓鞘变性、轴突损伤和神经元缺失。机制上,miR-15a/16-1与AKT3和IL-10RA的3'-UTR结合。miR-15a/16-1的遗传缺失增加了VCID大脑中AKT3和IL-10RA的表达,而鼻内递送负载AKT3和IL-10RA siRNA的纳米颗粒部分降低了VICD后miR-15a/16-1 KO小鼠的脑保护和认知恢复。总之,miR-15a/16-1-IL/10RA/AKT3轴在调节VCID后的血管性脑损伤和认知能力下降中起关键作用。靶向miR-15a/16-1是一种治疗VCID的新型治疗方法。

Fig1. MiR-15a/16-1遗传缺失可防止VCID后小鼠的长期髓鞘丢失和轴突损伤
原文链接:https://pubmed.ncbi.nlm.nih.gov/35403823/
Aberrant miR-339-5p/neuronatin signaling causes prodromal neuronal calcium dyshomeostasis in mutant presenilin mice
异常的miR-339-5p/neuronatin信号导致突变型早老素小鼠的前驱病状神经元钙稳态失衡
发表期刊:J Clin Invest
影响因子:14.808
发表时间:2022年4月15日
大量出现脊柱丢失和钙稳态失衡是与年龄相关的神经退行性变(例如阿尔茨海默病,AD)的早期标志性事件,这与认知大脑区域早期病理学中的神经元过度活跃有关。然而,这些关键事件是如何在分子水平上触发疾病初始阶段发生的神经元异常的,目前仍不清楚。本研究在家族性AD(FAD)的早老素-1 M146V敲入(PSEN1-M146V KI)小鼠模型的皮层神经元中鉴定出下调的miR-339-5p及其靶蛋白neuronatin(Nnat)的上调。抑制miR-339-5p或过表达Nnat可重现PSEN1突变的皮质神经元中的脊柱缺失和内质网钙超载。相反,miR-339-5p的过表达或Nnat的敲低可恢复脊柱形态发生和钙稳态。研究人员使用光纤光度法记录了客体认知过程,进一步证明PSEN1突变体导致脾后皮层神经元反应的习惯化缺陷,这可以通过恢复miR-339-5p/Nnat通路来挽救。因此,本研究结果揭示了miR-339-5p/Nnat通路在FAD中的关键作用,可作为早期发病机制的潜在诊断和治疗靶点。

Fig2. 本研究模型示意图
原文链接:https://pubmed.ncbi.nlm.nih.gov/35426376/
Microtubules promote the non-cell autonomous action of microRNAs by inhibiting their cytoplasmic loading onto ARGONAUTE1 in Arabidopsis
微管可促进拟南芥中microRNA的非细胞自主作用
发表期刊:Dev Cell
影响因子:12.270
发表时间:2022年4月7日
移动microRNAs(miRNAs)在植物的发育模式和胁迫应答中起着局部和远程信号的作用。然而,控制miRNAs非细胞自主活动的机制仍然不清楚。本研究表明,在拟南芥根中,破坏微管动力学的突变对于移动miRNAs的非细胞自主行为是有特异性缺陷的,其中包括miR165/6,其在内皮层中产生并移动到脉管系统以确定木质部细胞命运。研究表明,源细胞(source cells)中需要KTN1(一种微管切断酶的亚基)来抑制miR165/6装载到细胞自主的ARGONUATE1(AGO1)中,以使miRNA能够离开细胞。微管破坏增强了细胞质中miR165/6与AGO1的关联。这些发现表明,虽然细胞核中细胞自主的miRNAs装载到AGO1上,但移动miRNAs的细胞质AGO1装载是微管调节以促进miRNA在细胞间运动范围的关键步骤。

Fig3. 微管调节microRNA非细胞自主作用的模型示意图
原文链接:https://pubmed.ncbi.nlm.nih.gov/35429434/
MicroRNA networks in FLT3-ITD acute myeloid leukemia
FLT3-ITD急性髓系白血病中的MicroRNA网络
发表期刊:Proc Natl Acad Sci U S A
影响因子:11.205
发表时间:2022年4月19日
MiR-126和miR-155是分别调节造血细胞静止和增殖的关键microRNAs(miRNAs)。本研究发现在急性髓系白血病(AML)中,这两种miRNAs的生物发生是通过一个由FLT3-ITD(FMS样酪氨酸激酶3-内部串联重复)驱动的调节环网络相互连接的。事实上,FLT3-ITD通过一种涉及细胞质Drosha核糖核酸酶III(DROSHA)的非典型miRNA生物发生机制诱导miR-155的表达。反过来,miR-155下调SHIP1(含SH2结构域的肌醇磷酸酶1),从而增加磷蛋白激酶B(AKT),进而丝氨酸磷酸化、稳定和激活SPRED1(Sprouty相关EVH1域包含1)。激活的SPRED1抑制RAN/XPO5复合物并阻断pre-miR-126从细胞核到细胞质的转运,从而无法完成生物发生的最后步骤。最终结果是异常低水平的成熟miR-126允许静止的白血病细胞被募集到细胞周期中并增殖。因此,增殖性AML原始细胞中miR-126的下调是FLT3-ITD依赖性miR-155表达的下游,该表达启动了一个复杂的串联调节反馈回路(即miR-126/SPRED1、miR-155/ DDX3X)和前馈(即miR-155/SHIP1/AKT/miR-126)调节环,最终汇聚成白血病生长的输出信号。
原文链接:https://pubmed.ncbi.nlm.nih.gov/35412895/
Mouse mesenchymal stem cell-derived exosomal miR-466f-3p reverses EMT process through inhibiting AKT/GSK3β pathway via c-MET in radiation-induced lung injury
小鼠间充质干细胞来源的外泌体miR-466f-3p在放射性肺损伤中通过c-MET抑制AKT/GSK3β通路逆转EMT过程
发表期刊:J Exp Clin Cancer Res
影响因子:11.161
发表时间:2022年4月7日
背景:放射性肺纤维化(RILF)是胸部放射治疗的常见并发症。肺泡上皮细胞通过上皮-间充质转化(EMT)在肺纤维化中起关键作用。源自间充质干细胞的外泌体具有修复和再生受损组织的有益特性,但其潜在机制仍知之甚少。
结果:mMSCs-Exos在90-150 nm范围内有效分离,并具有高表达的外泌体标志物(CD63、TSG101和CD9)。mMSCs-Exos给药可有效缓解辐射引起的肺损伤,胶原沉积较少,IL-1β和IL-6水平较低。同时,体外实验结果表明,mMSCs-Exos治疗明显逆转了辐射诱导的EMT过程。在外泌体中富集的miRNA装载物中,miR-466f-3p主要负责通过抑制AKT/GSK3β通路产生保护作用。机制研究进一步表明,c-MET是miR-466f-3p的直接靶标,其恢复部分消除了mMSCs-Exo介导的对EMT过程和辐射诱导的AKT/GSK3β信号活性的抑制。
结论:研究结果表明,源自mMSCs的外泌体miR-466f-3p可能具有抗纤维化特性,并通过c-MET抑制AKT/GSK3β来预防辐射诱导的EMT,为辐射诱导的肺纤维化提供了一种有前景的治疗方式。

Fig4. mMSCs来源的外泌体miR-466f-3p通过靶向c-MET的AKT/GSK3β通路保护小鼠肺免受辐射损伤模型示意图
原文链接:https://pubmed.ncbi.nlm.nih.gov/35392967/